エドマン分解とは
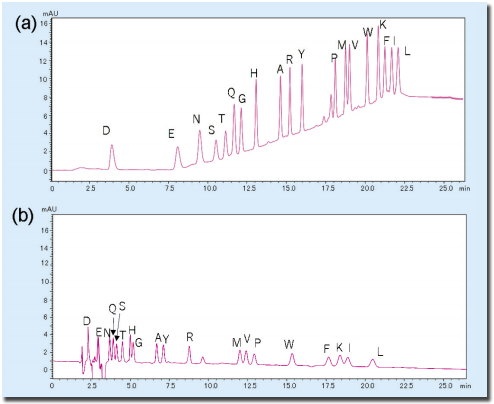
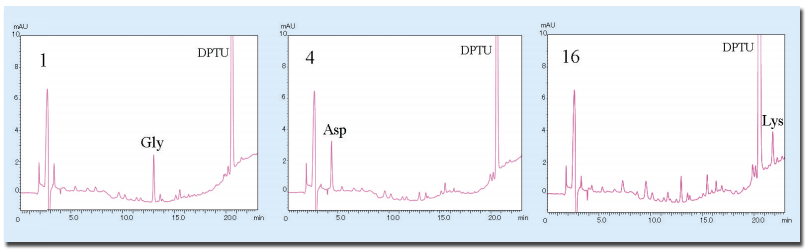
これまで述べたように、ラクトフェリシンを抗原として作成されたモノクローナル抗体に対する反応性を有するペプチド画分が得られ、またそのペプチドの質量が4069であることも判明しました。 次の段階としてこのペプチドがラクトフェリンのどの部分に相当するのかを決定するために、本章で述べるアミノ酸配列の決定を行ない、N末端から11残基までの配列 TAGWNIPMGLI が決まりました。 このペプチドの質量と付き合わせると、ラクトフェリン全配列のどの部分かを決めることができます。 なお、Cローブを調製した際にもそのN末端アミノ酸配列 YTRVVWXAVGPEEQKKQX およびC末端アミノ酸配列 FLTR を確認しています 1。 この場合、以下に述べるようにN末端アミノ酸配列はPTH誘導体として、C末端アミノ酸配列はPTC誘導体としてC18カラムで分析しました。 エドマン法によるアミノ酸配列の決定 アミノ酸配列の分析にはエドマン Edman 法を自動化した装置(ペプチドシークエンサあるいはプロテインシークエンサともいう)が用いられます。 エドマン法とは、タンパク質あるいはペプチドのN末端部分の遊離アミノ基にフェニルイソチオシアネート PITC を反応させ、フェニルチオカルバミル誘導体 PTCアミノ酸 とし、次いでトリフルオロ酢酸 TFA によってアニリノチアゾリノン ATZ -アミノ酸として遊離させ、さらに酸性下で安定なフェニルチオヒダントイン PTHアミノ酸 に変換して分析するものです。 装置としては上記の反応を繰り返して自動的に行なわせる部分と、遊離したPTHアミノ酸をC18カラムで分析する高速液体クロマトグラフィー HPLC 、およびその制御とデータ処理のためのパーソナルコンピュータで構成されています。 1サイクル約1時間で終了し、PTHアミノ酸の検出は、269 nmでの吸光度を測定することによって行います。 なお、分析用の試料が溶液状態の場合はポリブレン処理したカートリッジフィルター(ガラスファイバーフィルタ)に、またはPVDF膜に吸着させて分析を行ないます。 この際に必要な試料量としては、機種によりますが10 pmol程度です。 アミノ酸配列分析用試料の調製 アミノ酸配列のための試料は高純度に精製したタンパク質やペプチドで、最終的に逆相クロマトグラフィーで精製することが推奨されています。 その他に、SDS電気泳動や二次元電気泳動を行ったゲルからPVDF膜に転写して色素染色し、目的のバンド(スポット)を切り取り、よく洗浄して緩衝液成分のグリシンなどを完全に除いてから配列解析に用います。 また第5、8章で述べたように、電気泳動を行ったポリアクリルアミドゲルからタンパク質を抽出し、あるいはゲル中でプロテアーゼを作用させて得られた反応物から逆相クロマトグラフィーで各成分を分画し、そのフラグメントのアミノ酸配列を決める方法もあります。 あるいはPVDF膜に固定化した目的タンパク質を還元アルキル化した後、酵素消化します。 回収したペプチド混合物を逆相クロマトグラフィーで分画し、アミノ酸配列の分析を行います。 C末端側アミノ酸配列の決定法 C末端側のアミノ酸配列を決定するには、カルボキシペプチダーゼY(carboxypeptidase Y)などによる逐次分解法を行い、C末端側から順次遊離するアミノ酸残基を同定する方法が用いられます。 具体的には、ペプチドを0. 2 Mエチルモルフォリン pH 5. 9 溶液に溶解して加熱変性させ、次いで0. 1Mリン酸緩衝液 pH 5. アミノ酸分析計の代わりに質量分析計 第8章を参照 を用いて同定する方法もあります。 カルボキシペプチダーゼの濃度を変えて反応させると、ペプチド鎖長の異なる集団ができます。 この反応を質量分析用試料プレート上で行い、イオン化促進試薬を加えて質量スペクトルを測定しC末端アミノ酸配列を同定します。 これをラダーシークエンス法といいます。 また、固定化アンヒドロトリプシンのLysやArgに対する強い親和性を利用し、これらをC末端に含むペプチドを除いて本来のC末端部分を含むフラグメントを得、N末端側からアミノ酸配列を決める方法もあります。 トリプシンかリジルエンドペプチダーゼで限定分解しますが、目的タンパク質あるいはペプチドのC末端アミノ酸がLysやArgである場合には、キモトリプシンで分解します。 補足 a アミノ酸シークエンサ、ペプチドシークエンサ、プロテインシークエンサは同じ意味で使われています。 質量分析器を用いる方法に比べて特段の技術革新が無く、現在も市販されている装置は島津製作所のシークエンサだけとなったようです。 しかし、データベースに無いアミノ酸配列を持ったタンパク質やペプチドの配列決定には必須の技術です。 そこで、手持ちのHPLC装置にC18カラムを用い、紫外可視検出器を組み込んでPTHアミノ酸が分析できるようにし、各種反応試薬を用意してエドマン分解の操作を手動で行う方法 5-7 があります。 1サイクル1時間ほどです。 b アンヒドロトリプシンはトリプシンの活性中心のSerをフェニルメタンスルホニル化したもので、Lys,Arg,アミノエチル化システインに対する親和性がトリプシンよりも大きく、強く結合します。 c プレラベルする方法には、PTH法やPTC法の他にアミノクローム法(Dabsyl化)などがあります。 d 塩酸加水分解ではTrpは壊れてしまい、分析出来ません。 そのため、アルカリ加水分解法、あるいは他の個別定量法が用いられます。 e ポリブレン polybrene は多価の第四級アミン高分子化合物で、ガラス繊維の表面に試料を強く保ちます。 f 酢酸の融点は16. なお、無水酢酸は水を加えても酢酸とはならず、アミノ基をアセチル化するので要注意! g アシル基でブロックされたN末端を有するタンパク質でも分解するアミノペプチダーゼも報告されています。 h 定沸点塩酸は塩酸を2倍に希釈したものを蒸留して得られ、5. 参考図書 1 Shimazaki, K. et al. , J. Dariy Sci. , 76, 946-955 1993 2 Methods in Enzymology, 91. Enzyme Structure Part I.. 26-36 1983 3 Pierce,A. et al. , Eur. Biochem. , 196, 177-184 1991 Accession No. X57084 4) Shimazaki, K. et al. , Advances in Lactoferrin Research, 41-48, edited by Spik,G. , et al. , Plenum Press 1998 5 「生化学実験講座1タンパク質の化学II 一次構造決定法」日本生化学会編、東京化学同人(1976) 6 「生物化学実験のてびき2タンパク質の分離・分析法」泉・中川・三輪共編、化学同人(1985) 7 「新生化学実験講座1タンパク質-II 一次構造」日本生化学会編、東京化学同人(1990) Briggs,M. Protein Chem. 38, 109-180 1986 「マイクロシークエンスのための微量タンパク質精製法」ポール・マツダイラ編、羊土社(1992) 「遺伝子クローニングのためのタンパク質構造解析・ブロッティングとシークエンシング」平野久、東京化学同人(1993) 問題 問1.図9-1のウシラクトフェリンのアミノ酸配列はcDNAのヌクレオチド配列から求めたものです。 一方、ラクトフェリン分子のN末端側の部分アミノ酸配列はAPRKNVRWCTであること、および牛乳中に見出されるラクトフェリンは689残基から構成されていることが分かっています。 Mから始まる19残基からなるペプチドは一体どういうものですか。 図9-1. ウシラクトフェリンのアミノ酸配列(一次構造) 3。 126I はVとも報告されています。 問2.ラクトフェリンには数カ所に糖鎖がついています。 アミノ酸配列上で糖鎖付加の可能性のある部分 sequonsという を示して下さい(第12章を参照)。 その他、本文中に記述したアシル化された残基をフリーで使える化学構造式描画ソフト(付録のソフトウエアとウエッブサイト一覧を参照)で描いて下さい。 問4.N末端から逐次アミノ酸配列を決める方法では30残基程度しか決まりません。 数百残基から成るタンパク質の全配列をエドマン法で決めるにはどのようにしたらよいですか。 問5.ニンヒドリン法でアミノ酸を検出する場合、Proの感度が低いのは何故ですか。 また、アミノ酸分析計ではProも同時に定量するためにどのような方法をとっていますか。 問6.アミノ酸分析で、ポストカラム法およびプレカラム法で用いるラベル化試薬の例をあげてください。 問7.カルボキシペプチダーゼにはYの他にどのようなものがありますか。 それらの起源、性質の違いなどについて述べて下さい。 問8.分子内SS結合の対 相手同士 を決めるには、どのような方法がありますか。 このペプチドのラクトフェリン分子内で最も可能性の高い最初と最後の位置をその質量 4069 から推定して下さい。
次の