周期表
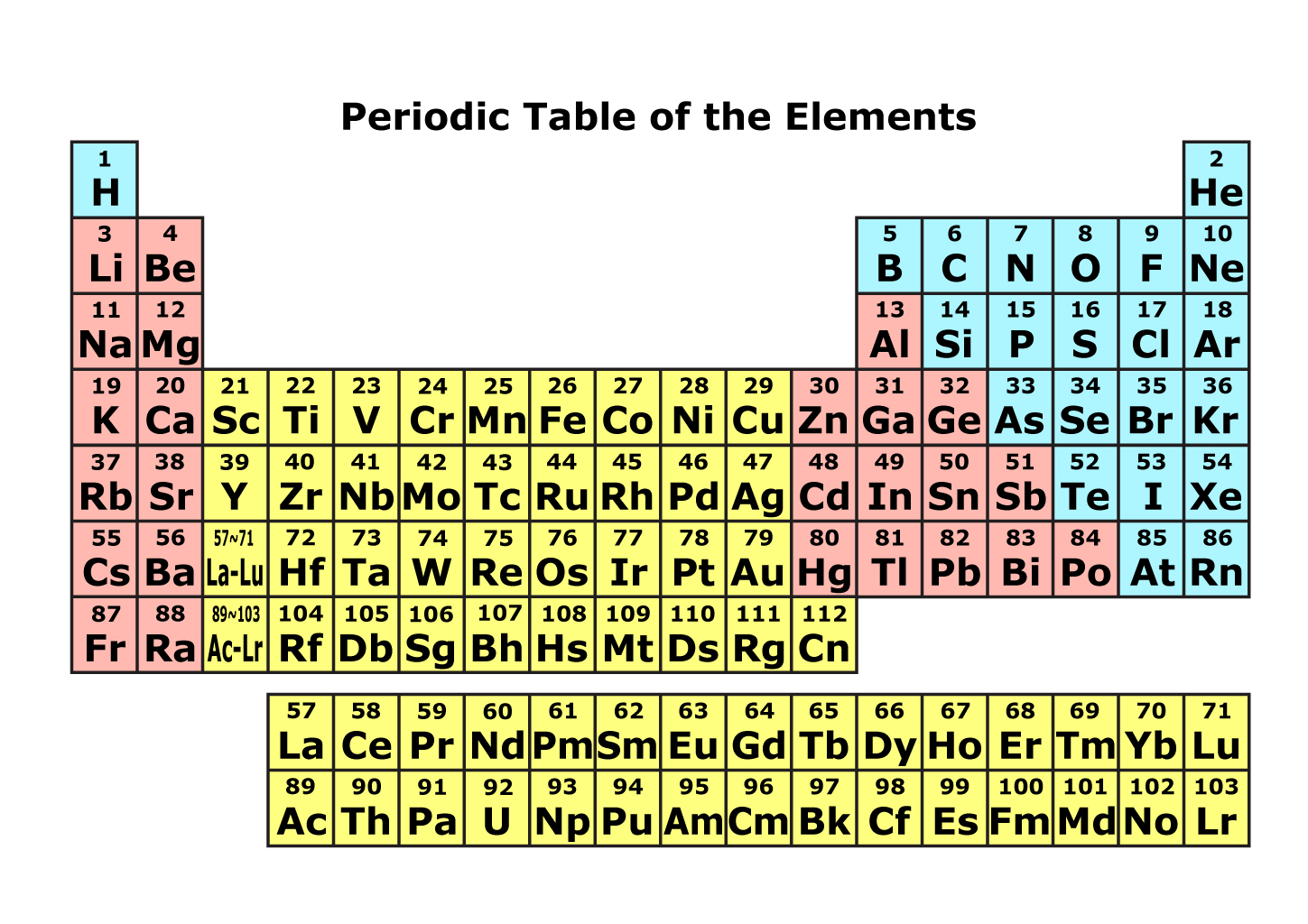
元素の周期表 The periodic table of the elements 1A 2A 3A 4A 5A 6A 7A 8 1B 2B 3B 4B 5B 6B 7B 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 1 水素 2 ヘリウム 2 3 リチウム 4 ベリリウム 5 ホウ素 6 炭素 7 窒素 8 酸素 9 フッ素 10 ネオン 3 11 ナトリウム 12 マグネシウム 13 アルミニウム 14 ケイ素 15 リン 16 硫黄 17 塩素 18 アルゴン 4 19 カリウム 20 カルシウム 21 スカンジウム 22 チタン 23 バナジウム 24 クロム 25 マンガン 26 鉄 27 コバルト 28 ニッケル 29 銅 30 亜鉛 31 ガリウム 32 ゲルマニウム 33 ヒ素 34 セレン 35 臭素 36 クリプトン 5 37 ルビジウム 38 ストロンチウム 39 イットリウム 40 ジルコニウム 41 ニオブ 42 モリブデン 43 テクネチウム 44 ルテニウム 45 ロジウム 46 パラジウム 47 銀 48 カドミウム 49 インジウム 50 スズ 51 アンチモン 52 テルル 53 ヨウ素 54 キセノン 6 55 セシウム 56 バリウム L ランタノイド 72 ハフニウム 73 タンタル 74 タングステン 75 レニウム 76 オスミウム 77 イリジウム 78 白金 79 金 80 水銀 81 タリウム 82 鉛 83 ビスマス 84 ポロニウム 85 アスタチン 86 ラドン 7 87 フランシウム 88 ラジウム A アクチノイド 104 ラザホージウム 105 ドブニウム 106 シーボーギウム 107 ボーリウム 108 ハッシウム 109 マイトネリウム 110 ダームスタチウム 111 レントゲニウム 112 コペルニシウム 113 ニホニウム 114 フレロビウム 115 モスコビウム 116 リバモリウム 117 テネシン 118 オガネソン アルカリ金属 アルカリ土類金属 希土類 チタン族 土酸金属 クロム族 マンガン族 鉄 族(上3元素) 白金族(中6元素) 銅族 亜鉛族 アルミ ニウム族 炭素族 窒素族 酸素族 ハロゲン 不活性ガス L ランタノイド 57 ランタン 58 セリウム 59 プラセオジム 60 ネオジム 61 プロメチウム 62 サマリウム 63 ユーロピウム 64 ガドリニウム 65 テルビウム 66 ジスプロジウム 67 ホルミウム 68 エルビウム 69 ツリウム 70 イッテルビウム 71 ルテチウム A アクチノイド 89 アクチニウム 90 トリウム 91 プロトアクチニウム 92 ウラン 93 ネプツニウム 94 プルトニウム 95 アメリシウム 96 キュリウム 97 バークリウム 98 カリホルニウム 99 アインスタニウム 100 フェルミウム 101 メンデレビウム 102 ノーベリウム 103 ローレンシウム 1 H 水素 原子番号 元素記号 元素名 番号 元素を記号で表したもの 元素の名前 周期律表は、性質や特徴を考慮して元素を並べたものです。 それぞれの記号は 元素記号と呼ばれおり、それぞれの元素を表現しやすく記号にしたものです。 原子番号は、元素を順番に並べたものを左上から数字をつけたものです。 表の縦の列である族番号が同じ元素は性質が似ているといった特徴があります。 周期番号 族番号 A, B 族番号 非正式 典型金属元素 典型非金属元素 遷移金属元素 超ウラン元素 未発見 原子 原子は、中心に正の電荷を持つ原子核とその周りを飛び回っており負の電荷を持つ電子からできています。 原子核は正の電荷を持った陽子と電荷を持たない中性子からできています。 その、原子核中の陽子数を原子番号といいます。 原子核の周りを回る電子の道筋(正確には電子の動き回るところ)を電子軌道と呼びます。 電子は、軌道が平面ではなく球状で立体的なのでその軌道を殻(電子殻)とも呼んでいます。 周期番号 電子の軌道(電子殻)は、大きい区分として内側から順に、K殻、L殻、M殻... と層状になっています。 これを、主殻といいます。 周期番号は、この電子殻の数をあらわしています。 同周期の原子では、原子番号が大きくなるほど原子核の電荷が大きくなって電子が強く引きつけられるため原子半径は少し小さくなります。 ボーアの原子モデル 電子殻名 K殻 L殻 M殻 N殻... 電子の収容数 2 8 18 32 2n 2 電子配置 電子殻は、さらに s,p,d,fなどといった軌道があります。 K殻は 1s軌道、L殻は 2s,2p軌道、M殻は 3s,3p,3d軌道に細分されます。 これを、副殻といいます。 この軌道は、軌道の形態によって分類されており、s軌道は対称な球形(1種類)、p軌道はxyzの各軸方向へ伸びた形(px、py、pzの3種類)をしています。 1s、2sなどの数字は、内側からの順番につけたもので、1がK殻、2がL殻にあることを表しています。 これらの軌道には、それぞれ2個の電子を収容できます。 以前、典型元素にAと遷移元素にBをつけて区別していたが、1989年に国際純正応用化学連合会(IUPAC)の無機化学命名法の改訂にともなって周期表の族の名称,番号の表記方法が1〜18族に改められられた。 アメリカでは今でも区別している。 同族の原子では、周期が大きくなるほど外側の電子殻に電子が入るため原子半径は大きくなります。 典型金属元素 金属元素のうち、遷移金属の系列にない物です。 典型元素は、電子が最外殻に配置されていきます。 つまり、電子が最外殻の軌道 s軌道,p軌道 に順次配置され金属としての特有の性質を持します。 典型非金属元素 非金属とは、その名の通り「金属ではない」という意味です。 したがって、ここに分類される元素は金属結合を行わず金属に特有の性質を持ちません。 単体では、気体である物が半分ぐらいあり電導性を持ちません。 (炭素などの例外はある)典型元素は、電子が最外殻に配置されていきます。 遷移金属元素 遷移元素は全て金属元素です。 遷移元素は、電子が最外殻に配置されずに内側の軌道 d軌道,f軌道 配置されていきます。 遷移元素のうち、電子が 4f軌道に配置されていくものをランタノイド、5f軌道に配置されていくものをアクチノイドといいます。
次の
名古屋市科学館

解説 [ ] 周期表は原則的に、左上からの順に並ぶよう作成されている。 周期表上で元素はその原子のに従って並べられ、似た性質の元素が規則的に出現する。 同様の主旨を元に作成された先駆的な表も存在するが、一般に周期表はにのによって提案された 、順に並べた元素がある周回で傾向が近似した性質を示す周期的な特徴を例証した表に始まると見なされている。 この表の形式は、新元素の発見や理論構築など元素に対する知見が積み重なるとともに改良され、現在では各元素のふるまいを説明する洗練された表となっている。 周期表は、錬金術師、化学者、物理学者、その他の科学者など、無数の人たちによる知の集大成である。 元素の性質を簡潔かつ完成度が高く示した周期表は「化学のバイブル」とも呼ばれる。 現在、周期表は化学のあらゆる分野で、の分類や体系化および比較を行うための枠組みを与えるものとして汎用的に用いられている。 そして、化学だけでなく物理学、、を中心に全体に、多くの法則を示す表として用いられる。 が1個であるから始まり、1マス進むごとにが1つ多いを示しながら並べる。 周期律に沿って改行され、2段目・3段目…と順次追加されてゆく。 そのため、左から右へ、また上から下へ行くにつれて原子番号が大きな元素が並ぶ。 しかし周期表はではなく、中央に谷間があるおおまかな凹型をしている。 これは周期律が示す元素の近似的な性質が必ずしも同じ原子番号ので現れない現象を反映しているためである。 周期表において右端にある原子番号2のと近い性質を持つ元素の仲間(という)では、次に現れる元素は原子番号10のであり、その次は(元素番号18)となる。 ここまでは原子番号数の差分はいずれも8だが、続く仲間は(同36)、(同54)と、増分は18に増える。 上に示された一般的なレイアウトの周期表では、この18で一巡しで改行する法則を採り、縦方向でまとまる元素の族を1 - 18族という名称で設定する。 このためヘリウムやネオンがある行では途中に空白が生じ、結果として周期表は凹型となる。 ところが希ガスにおいてキセノンの下に続く元素は(同86)であり、差分は32に増える。 これを1元素1マスを使い表示したという形式もあるが、一般的なレイアウトでは原子番号57-71までを、89-103までをとして纏めて切り離し、欄外に表示する。 結果この周期表は縦18列、横7段、欄外2行の枠組みで構成される。 この形式はのがに提唱したもので、現在でも国際的なとなっている。 周期表には118個の元素が表示されており、これらすべてに正式な元素名がつけられている。 ただし、原子番号82のまでが安定な元素である 原子番号83のの同位体は全て放射性と判明。 詳細は「」および「」を参照 メンデレーエフが各元素を特徴から並べた時には、未だ原子の構造ははっきりとわかっていなかった。 どのような理論でこれら元素の特徴がもたらされるかは、になって原子の構造を示すとを取り扱う理論が確立され、原子には陽子数(原子番号)と同じ数のが陽子核のまわりにと呼ばれる層を形成して存在すること、この殻は複数あり、電子は基本的に内側から順番に埋まってゆくことが判明した。 そして、最も外側の殻(にある電子())はなど変化においてやりとりがしやすく 、このためその個数が元素の性質を決める要因だということが分かった。 ところが、単純に電子殻を内側から埋めてゆく法則は(原子番号18)までにしか当てはまらない。 現在のところ電子殻が複数定められており、内側からK・L・M・N・O・P・Qと名称が続いてつけられている。 さらにこれは、()に基づくによって電子が順に埋まる電子軌道(、subshells)に分けられる。 このうち第4周期において、4s軌道は3d軌道よりも先に電子が満たされる傾向がある。 そのため(同19)から(同28)まではM殻に空席がある状態でN殻の4s軌道に電子が配置され、これが最外殻として元素の性質を形作る。 そして、周期表のへこんだ中央部にあるこの元素群は表の横方向で近似した傾向を備え、これらに該当する3—11族はと呼ばれ、このような特性は第4周期以降の長周期と呼ばれる部分で現れる。 未だ電子の存在が解明されていなかった時代、メンデレーエフはこの元素の一群をどう解釈すべきかで非常に頭を痛めたという。 このような現象が起こる理由について、現在ではM殻内の電子同士が負電荷で反発するために起こると説明されている。 分類 [ ] 族 [ ] 詳細は「」を参照 周期表において元素が表示された位置関係は、その化学的特性を予想することを可能とする。 列に沿って左右を見比べるよりも、縦に並んだマスを比較する方に留意して見るべきである。 (groupまたはfamily)は、周期表における縦方向の集合である。 この族は元素を分類する上で最も重要な方法と考えられている。 いくつかの族に当る各元素の特性は非常に似かよっており、原子量が多くなる方向で明らかな傾向が見られる。 この族には名称がつけられているが、それらは(alkali metals)、(alkaline earth metals)、(pnictogens)、(chalcogens)、(halogens)、(noble gases)と、統一性があまり無い。 など周期表におけるその他の族は垂直方向での近似性があまり見られず、基本的に族の数字で表されることが多い。 現代の理論が要請する原子の構造は、族が持つ傾向で説明され、それは特性ごとに分ける上で最も重要な要素に影響を与える原子価殻において電子配置が同一である原子は同じ族に含まれる。 同じ族の元素グループには・・の傾向にも近似性が見られる。 上から下に行くにつれ全体のエネルギー値が高くなるため、原子価電子は原子核から遠くなってゆき、元素の原子半径は大きくなる。 原子全体が電子を捕まえる力は強くなるため、下に行くほどイオン化エネルギーは小さくなり、同様に原子核と原子価電子の距離が長くなるにつれ電気陰性度も低くなる。 周期 [ ] 詳細は「」を参照 (period)は、周期表のおける横方向の集合である。 基本的に各元素の特性に族で示される程の似かよった所は無いが、例外的な箇所もある。 これは、と、特にやにおいて、水平方向で近似性を持つ特徴が相当する。 この周期は、最外電子殻が内側から何番目であるかを表している。 同じ周期にある元素は原子半径、イオン化エネルギー、、電気陰性度のパターンで似た傾向を示す。 左から右に行くにつれ、一般に原子半径は小さくなる。 これは、元素に含まれる陽子の数は段々と増えるため、それに応じて電子が原子核にひきつけられるためである。 これに伴ってイオン化エネルギーは大きくなり、希ガスで最大となる。 原子半径が小さくなると全体を捉える力が強まり、電子を引き剥がすために必要なエネルギーが大きくなる。 電気陰性度も同じく核による電子の牽引力が増すため大きくなる。 電子親和力の周期内による変化傾向はわずかである。 周期表左側にある金属元素は一般に、希ガスを除いて右側の非金属元素よりも電子親和力は低い。 その他 [ ] 元素は他の集合でも分類され、周期表の縦横またはブロックでも示しにくい場合がある。 ・元素と元素の区分は暗示的にしか表現されない階段状の斜め線で区別されている。 その線の右側が非金属元素、左側が金属元素であり、間に半金属が挟まれている。 金属が持つ典型的特徴である電子を放出しやすい性質は、周期表の左下で強くなる。 また、単体が常温常圧下で取る(・・)もブロックでは表しにくい。 全体の傾向は水素と右上のヘリウム付近(窒素から右、塩素から右および希ガス)が気体であり、例外的に液体の相となるとを除いた元素は固体である。 このような分類は、マスや文字色などそれぞれの周期表で工夫をこらした表現で示される場合もある。 歴史 [ ] の「地のらせん」概略図 先駆的な周期律の考察 [ ] 後半から前半にかけて化学の発展に伴い元素が数多く発見され、にが作成したリストでは33個の元素が記載された。 までにその数は55種まで増え、それとともに化学者の中には漠然とした不安が持ち上がっていた。 元素は一体何種類あるのか、そしてこの増えるばかりの元素には何かしらの法則性が隠されていないのだろうかという疑念である。 、ドイツのはに発見されたの色や反応における性質、そして原子量がおよびの中間にあることに気づいた。 彼は他にも同様の組み合わせが無いか研究したところ、--と--にも同じような性質の近似性があることを見つけた。 デーベライナーはこの組み合わせをと名付けた。 当時、原子量と分子量、そしては明確に区別されておらず、混同も多かった。 にのが「地のらせん」という説を発表し、円筒状の紙に元素を螺旋型に並べると垂直方向に性質が近似した元素が並ぶと唱えた。 しかし彼はにおける的な「数秘学」という方法でこれを説明し、的確な図を添付しなかったために他の科学者には理解されなかった。 1864年、のが当時知られていた元素を並べると、最初(水素)と8番目(フッ素)の性質が似ており、以下2番目(リチウム)と9番目(ナトリウム)も同じ傾向があり、これは7番目()と14番目(硫黄)まで同様に見られることを、音楽の音階になぞらえて「」と名付けて発表した。 ただしこれはさらに大きな元素には当てはまらなかったために賛同を得られず かえって「では元素記号のアルファベット順に並べたらどうなる」と嘲笑の的になった。 、ドイツのは既知49種類の元素を原子容(原子体積)に着目し 16列にわけた周期表を考案した。 これは電子価が同じ元素が近似した性質を持つことを表していた。 メンデレーエフの周期表 [ ] メンデレーエフが1869年に、最初に作成した周期表 ドイツのは、原子量や分子量などの概念が固まっていないことを問題視し、にで「元素の質量測定」を命題とした史上初の国際化学者会議を開催した。 この会議に出席したロシアのであり化学者であったメンデレーエフはそこでのが主張する原子量を重視すべきという主張 に影響を受けた。 帰国後メンデレーエフはの教授となった1869年に、化学のを執筆していた際 、当時63個まで発見数が増えていた元素を説明する方法に悩んでいた。 彼は好きなカードゲームから発案し、元素名を書き込んだカードを何度も原子量順に並べ替えることを繰り返す内にひとつの表を作り上げた。 それは原子価を重視し、かつ適切に当てはまる元素が無い箇所は「エカホウ素」「エカアルミニウム」「エカケイ素」(「エカ」はで「1」の意味 )など仮の名をつけた空白とする工夫を施したものだった。 この表はにドイツの科学雑誌で発表された。 メンデレーエフの第二周期表。。 表の上部には水素化物と酸化物があるように、彼は化合物を重視してこの表を作成した 当初この表に価値を認める学者はほとんどいなかった。 しかし、マイヤーはこれに注目し、原子容の考え方を加えた論文を発表した。 彼は原子量順の原子容を調べたところ、リチウム・ナトリウム・カリウムと並ぶアルカリ金属族に該当する元素は原子容が前後と飛びぬけて高いことを示した。 メンデレーエフはマイヤーの論文も参照し、改良を加えた周期表(第二周期表)を作成した。 これにはローマ数字IからVIIIで縦の分類が施され、うちI—VIIが基本的に1—2族および13—17族に対応し、VIIIには遷移元素群を入れ、また希ガスは反映されていなかった。 それぞれには2種類の亜族を設け、表の左右に振り分けて区分した。 認められた周期表 [ ] メンデレーエフの周期表はすぐに認められたわけではなかった。 しかしにのが新元素を発見し、これが「エカアルミニウム」と一致することが判明すると周期表が注目を浴びるようになった。 その後もの(「エカホウ素」)、1886年の(「エカケイ素」)がメンデレーエフの表にある空白を埋めるものだということが判明し、彼の周期表の正しさが証明された。 これに伴って「オクターブの法則」のジョン・ニューランズも再評価され、にイギリス化学学会から賞を授与された。 逆のケースもあった。 にの小村で発見された鉱物群から多くの新元素が見つかっていたが、までにその数は14種までになった。 これらはいずれも近似した性質を持ちと呼ばれたが、メンデレーエフの周期表を元にすると、いずれの族にも納まらない。 この問題は常に意識されていたが、以降にランタノイドが概念化され決着を見た。 希ガスを反映 [ ] メンデレーエフは化合物のでき方、すなわち原子価を重視して周期表を作成した。 ここに、に(レイリー卿)とが発見した新元素が立ちはだかった。 「怠け者」を意味する化合物を作らないアルゴンをどのように周期表の中に組み込むべきかが悩まれた。 しかしまでに同様な性質を持つヘリウム・ネオン・クリプトン・キセノンが相次いで発見され、これらも周期表の族の一種だと考えられるようになった。 これら元素はと呼ばれたが、原子価を示すとゼロとなる。 原子モデル構築 [ ] 周期表で示される元素の性質を作り出す構造は、にが提唱したで理論説明が成された。 彼の理論によって、元素は電子配置によって性質が左右し、その軌道が周期表の周期と対応していることが説明された。 色々な周期表 [ ] 実物周期表(の展示) 周期表に表示される情報 [ ] 周期表の各マスには、最低限元素記号と原子番号が記される。 大きな周期表においては、これに加えさまざまな情報が追記されたものもある。 日本ならばの名称というように作成地域のにおける元素名、原子量や価電子数、さらに拡張的なものでは電子配置や利用例なども加えられることがある。 原子量について、元素の多くはを持つ。 これらの原子量は一定ではないため、表記する際には慣例的にが最も長い同位体をつきで示す。 なお、原子量には絶対質量と相対質量があり、後者は質量数12の炭素( 12C)を基準「12」と置いて設定される。 これには物理学会と化学学会の紆余曲折があり、頃に酸素を基準に置いていたところ、に3つの同位体の存在が判明し、物理では厳密に 16Oを基準と定めたが化学では従来通り3同位体が混ざった状態を基準としていた。 これらの統一はに検討がなされたが、 16Oを基準に置くと化学での数字が0. 水素の位置 [ ] 現在一般的な周期表では、水素は最も左上の場所にある。 しかしこれは適切ではないのではという意見が過去IUPACの雑誌にて提唱された。 現状では水素は、最外殻に一つの電子を持つ1族の位置にあるが、以下でこの属はアルカリ金属を指しており、金属ではない水素がここにある矛盾が指摘された。 また、電子殻(この場合亜殻の1p軌道)が満たされる状態からひとつ電子が少ないと捉えると、以下の17族()の仲間と考えることも可能であり、実際に水素はアルカリ金属的な性質とハロゲン的な性質を併せ持つ。 IUPACは水素の位置を左上端に置くとする見解を示しているが、などはこれらを考慮し、水素を第1周期の中央部分に置いた周期表を掲載した書籍を発行している。 また、周期表によっては、17族のフッ素の上に水素のための別枠を設け、ヘリウムの左隣に併記する方法をとった物も存在する。 また、ヘリウムも最外殻の電子数が2つであることを重視して2族のの上に置くべきという主張もある。 しかしヘリウムは希ガスの性質を持つため、右端に置く現状が最適という考えが一般的である。 立体周期表 [ ] 平面的な周期表では1族と18族が大きく断絶しているように見えるが、本来この2つの族は原子番号が隣り合っている通り、連続して示されるべきものである。 一般的な周期表は、いわば螺旋状に連なるべきものを無理に平面で表示している。 教授のは円筒の上に示すを考案し、立体的な周期表を示した。 欄外に置かれたランタノイドとアクチノイドを取り込んだ立体周期表を、化学者が提案した。 平面状の周期表を立てた棒に貼り付け、ランタノイドとアクチノイドの部分を直角に差し込んだもので、将来119番目以降の元素が発見された際に設ける必要が生じる欄外も取り込むことができる。 の化学者は、柱に取り付けた複数の透明なプレート上に各原子を配列し、プレートで同一の周期を示しながら、族を上から見下ろした際に元素の表示が重なって見えることで周期律を表す立体周期表を提案した。 これは、柱を中心にそれぞれの方向に近似する性質を持つ元素の集団が見通せ、それが規則的に増加する周期それぞれの性質を把握しやすい形となっている。 電子軌道による周期表 [ ] で分類する周期表もある。 分類は次の通り。 電子軌道周期表 周期 族または元素名 軌道名 1 1と18 1s 2 1と2 2s 13-18 2p 3 1と2 3s 13-18 3p 4 1と2 4s 3-12 3d 13-18 4p 5 1と2 5s 3-12 4d 13-18 5p 6 1と2 6s 4f 3-12 5d 13-18 6p 7 1と2 7s 5f 3-12と 6d 13-18 7p 様々な周期表 [ ]• ADOMAH 型、2006年 表記について [ ] 1960年代後半から1970年代前半まで、理科教育現場では1980年代頃まで 周期律表との用語が使われていたが、それ以降は主に「周期表」という表記がされている。 周期 律表は誤った用法との指摘もある が、古い用語で教育を受けた者が使い続けている 現実があると指摘されている。 参考文献 [ ]• 編集長:水谷仁『別冊周期表第2版』、、2010年。 竹内敬人『化学入門コース 化学の基礎』岩波書店、1996年、第1刷。 『化学の歴史』玉虫文一、竹内敬人訳、、2010年、第1刷。 大川貴史『高校化学とっておき勉強法』、2002年、第1刷。 斉藤一夫『元素の話』、1996年、初版第12刷。 富永裕久『 元素』、2005年、初版。 Atkins, P. 1995. The Periodic Kingdom. HarperCollins Publishers, Inc.. Ball, Philip 2002. The Ingredients: A Guided Tour of the Elements. Oxford University Press. Brown, Theodore L. ; LeMay, H. Eugene; Bursten, Bruce E. 2005. Chemistry: The Central Science 10th ed. Prentice Hall. Pullman, Bernard 1998. The Atom in the History of Human Thought. Translated by Axel Reisinger. Oxford University Press. 脚注 [ ] []• Whittaker, G. Allan; Mount, A. ; Heal, M. R 2002 , 中村 亘男 訳, ed. , 物理化学キーノート, シュプリンガー・フェアラーク東京, 2002-12, p. 208,• Andrews, Julian E. ; Brimblecombe, Peter; Jickells, Tim D. ; Liss, Peter. ; Reid, Brian J. ; 渡辺 正 訳 2005 , 地球環境化学入門, シュプリンガー・ジャパン, pp. 16,• IUPAC. 2008年2月13日時点の [ ]よりアーカイブ。 2011年1月4日閲覧。 村上雅人 編著; 阿部泰之 ら 2004 , 元素を知る事典 : 先端材料への入門, 東京: 海鳴社 2004-11発行 , p. 240,• Newlands, John A. 1865-08-18. Chemical News 12: 83. Bryson, Bill 2004. A Short History of Nearly Everything. London: Black Swan. 141—142. ; 斉藤隆央 訳 2003 , タングステンおじさん: 化学と過ごした私の少年時代, 早川書房,• Ball, p. 101. ; 小山慶太・輪湖博 訳 1996 , アイザック・アシモフの科学と発見の年表, 丸善, p. 261,• ptable. com. 2011年1月4日閲覧。 「まんが アトム博士の科学探検」(東洋出版)60ページ・187ページ• Chemistry. 2011年1月4日閲覧。 perfectperiodictable. com. 2011年1月4日閲覧。 58 2010 No. 4 p. 190-193, :• 三宅正二郎、関根幸男、金鍾得 ほか、 精密工学会誌 Vol. 66 2000 No. 12 P. 1958-1962, : 関連項目 [ ]• 外部リンク [ ] ウィキメディア・コモンズには、 に関連するカテゴリがあります。 ウィキバーシティに に関する学習教材があります。 (日本語)(原子量表、周期表、同位体組成表)• (日本語)(JPEGおよびPDF形式で周期表がダウンロード可能)• (英語).
次の


