白血病の兆候に気づく方法: 12 ステップ (画像あり)

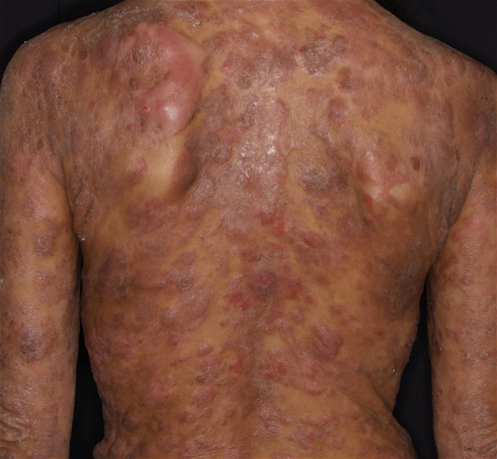
急性骨髄性白血病(AML-M6)の血液の例。 白血病では赤血球は減少していることがあり、逆に白血球が著明に増加していたり(減少していることもある)、血球の幼若球()が末梢血に出現したりする。 この画像では(健康人の血液では決して出現しないに似た)白血病細胞が著明に出現している。 なお、標本の作り方、観察方法によって顕微鏡写真像は異なるため、白血病の血液が皆、このように見えるとは限らない。 白血病(はっけつびょう、Leukemia)は、「の」ともいわれ 、遺伝子を起こした(白血病細胞)がで自律的に増殖して正常な造血を阻害し、多くは骨髄のみにとどまらず血液中にも白血病細胞があふれ出てくる血液疾患である。 白血病細胞が造血の場である骨髄を占拠するために造血が阻害されて正常なが減るためや、症状などの症状が出やすくなり、あるいは骨髄から血液中にあふれ出た白血病細胞がさまざまな臓器に浸潤(侵入)して障害することもある。 治療は、を中心としたとや感染症対策などのに加え、難治例ではやなどの治療も行われる。 白血病は、(AML)、(ALL)、(CML)、(CLL)の4つに分けられる。 — -引用、日本血液学会、日本リンパ網内系学会編集、『造血器腫瘍取扱い規約』金原出版、2010年、p. 2 としている。 白血病は病的な血液細胞(白血病細胞)が骨髄で自律的、つまりコントロールされることなく無秩序に増加する疾患である。 骨髄は血液細胞を生み出す場であり、骨髄での白血病細胞の増加によって正常な造血細胞が造血の場を奪われることで正常な造血が困難になり、血液(末梢血)にも影響が及ぶ。 あるいは骨髄から血液中にあふれ出た白血病細胞がさまざまな臓器に浸潤(侵入)して障害することもある。 白血病患者の血液中では白血病細胞あるいは病的な白血球を含めると総数は著明に増加することも、あるいは減少することもある。 しかし、正常な白血球は減少しやも多くの場合減少する。 白血病の症状として、正常な白血球が減ることで感染症(発熱)、赤血球が減少することでになり貧血に伴う症状(倦怠感、動悸、めまい)、血小板が減少することで易出血症状などがよく見られ、また血液中にあふれ出た白血病細胞が皮膚や神経、各臓器に浸潤(侵入)してそれらにさまざまな異常が起きることもある。 白血病は年に10万人あたりおよそ7人(2005年、日本)が発症する比較的少ないがんであるが 、多くの悪性腫瘍(癌、肉腫)は高齢者が罹患し小児や青年層ではきわめてまれなのに対し、白血病は小児から高齢者まで広く発症するため、小児から青年層に限ればがんの中で比較的多いがんである。 造血の場である骨髄で造血の元になっている細胞が変異したことによって起きるのが白血病であり、癌や肉腫のように固形のを形成しないため、胃癌や大腸癌などのようにの適応ではないが、抗がん剤などの化学療法にはきわめてよく反応する。 19世紀にドイツの病理学者(ウィルヒョウ、フィルヒョウとも)が白血病を初めて報告して Leukemia(白血病)と名付けた。 かつては白血病は治療が困難で、自覚症状が現れてからは急な経過をたどって死に至ったため、不治の病とのイメージを持たれてきた。 また、白血病は現代においても現実に若年層での病死因の中で高い割合を占めることから、では、かつてのに代わって、現代において癌と並び、若い主人公が罹患する設定になることが多い。 しかし、1980年代以降、や、(bone marrow transplantation; BMT)、(peripheral blood stem cell transplantation; PBSCT)、(cord blood transplantation; CBT)の進歩に伴って治療成績は改善されつつある。 一口に白血病といっても、大きくは(AML)、(ALL)、(CML)、(CLL)の4つに分けられ、それぞれは病態は異なっている。 急性白血病では増加する白血病細胞は幼若な血液細胞()に形態は似てはいるが、正常な分化・成熟能を失い異なったものとなる。 慢性白血病では1系統以上 の血液細胞が異常な増殖をするが、白血病細胞は分化能を失っておらず、幼若な血液細胞()から成熟した細胞まで広範な細胞増殖を見せる。 急性白血病細胞は血液細胞の幼若細胞に似た形態を取り 、多くの急性白血病では出現している白血病細胞に発現している特徴が白血球系幼若細胞に現れている特徴と共通点が多い細胞であるが 、多くはないが赤血球系統 や血小板系統 の幼若細胞の特徴が発現した白血病細胞が現れるものもあり、それらも白血病である。 血液細胞は分化の方向でリンパ球と骨髄系細胞 に分けられるが、ほとんどの白血病細胞も少しであっても分化の方向付けがありリンパ性と骨髄性に分けることができる。 白血病における慢性と急性の意味は、ほかの疾患でいう急性・慢性の意味合いとは違う。 急性白血病が慢性化したものが慢性白血病というわけではなく、白血病細胞が幼若な形態のまま増加していく白血病を「急性白血病」、白血病細胞が成熟傾向を持ち一見正常な血液細胞になる白血病を「慢性白血病」という。 白血病の歴史の中で、一般に無治療の場合には白血病細胞が幼若な形態のまま増加していく白血病の方が死に至るまでの時間が短かったため「急性」と名付けられた。 急性白血病が慢性化して慢性白血病になることはないが、逆に慢性白血病が変異を起こして急性白血病様の病態になることはある。 一般的に用いられる形容で、白血病を「血液の癌」と呼ぶが、この形容は誤りである。 漢字で「癌」というのは「の悪性腫瘍」を指し、上皮組織でなくである血液や血球には使えない。 ただし、「血液のがん」という平仮名の表記は正解である。 平仮名の「がん」は、「癌」や「肉腫」、血液悪性腫瘍も含めた広義的な意味で使われているためである。 やといった類縁疾患は通常、白血病には含まれないが、悪性リンパ腫とリンパ性白血病の細胞は本質的には同一であるとされ、骨髄異形成症候群にも前白血病状態と位置づけられ進行して白血病化するものもあり 、これら類縁疾患と白血病の境目は曖昧な面もある。 歴史と白血病の名の由来 [ ] 歴史 [ ] 試験管に血液を取り遠心分離すると上に血漿、下に赤血球が分離し、中間に白血球を含む白灰色の薄い層が現れる。 白血病では中間の白灰色の層の厚みが増していることがある。 19世紀半ば、ドイツの病理学者が巨大な脾腫を伴い、血液が白色がかって死亡した(今でいう慢性骨髄性白血病)患者を調べて報告したのが白血病の血液疾患としての最初の認知である。 ウィルヒョーの報告後、白血病は経過が比較的ゆっくりなものを慢性白血病、早いものを急性白血病と分類されている(現在の分類法とは異なる)。 1930年代には細胞科学的手法によってリンパ性と骨髄性に分類されるようになった。 しかしウィルヒョーの報告からほぼ100年にわたって、白血病に対する有効な治療法はなく、急性白血病は数週から数か月、慢性白血病は数か月から数年で死亡する死の病であった。 第二次世界大戦後には、抗がん剤が白血病に適用され始めたが、抗がん剤の種類も知見も少なく、血小板輸血やも乏しかった1960年代までは死の病である状況は変わらなかった。 1960年代からは抗がん剤の種類・知見も増加し、抗がん剤との多剤併用療法が開発され、さまざまな抗生物質も登場した。 その後、1970年代から研究の始まった造血幹細胞移植が1990年代から本格的に適用され始め 、だけでは長期生存は難しい難治例でも移植で2 - 6割の患者は長期生存が期待できるようになった。 また急性前骨髄球性白血病(AML-M3)で画期的な治療法である分化誘導療法の発見、2001年には慢性骨髄性白血病(CML)の分子標的薬の登場など、AML-M3やCML、予後がいい小児ALLなどでは大半の患者が救われるようになってきている。 ウィルヒョーが見た患者では極端に白血球が増加し血液が白っぽくなっていたと考えられるが、実際に血液が真っ白になることはなく、白血病細胞が極端に増えた例で通常は濃い赤色である血液が赤から灰白赤色になるだけで、ほとんどの白血病患者では血液の色は赤いままである。 血液の赤色は赤血球の色であるが、赤血球が完全になくなる前に人は死亡するため血液が完全に真っ白になるまで生存することはできない。 白血病によって貧血が強くなると血の色が薄くはなる。 また同様に、(M6)でも血がピンクになるわけではない。 一方、では血の中に中性脂肪が溜まり血が乳白色となるが、これは白血病とは呼ばない。 ちなみに健康人の血液を遠心分離すると下層には濃い赤色の赤血球、上層には黄色みかかった透明の血漿に分離するが、中間にはやや灰色がかった白い薄い層が現れる。 白い層をなす血液細胞をギリシャ語由来の(白い)を意味する leuko と細胞を表す cyte をあわせて Leukocyte:白血球と名付けられた。 白血球の一つひとつは実際には無色半透明だが多く集まると光を乱反射して白く見える。 白血病患者のほとんどでは白血球あるいは白血球同様に無色半透明な芽球が増加しているため、血液を遠心分離すると中間の白い層の厚みは増加している。 白い層の増加の程度が甚だしいと血液の色も変化する。 症状 [ ] 急性骨髄性白血病(AML-M4 において白血病細胞の浸潤で腫脹した歯肉。 ただし、歯肉腫脹する疾患は白血病だけでなく、また白血病であっても必ずしも歯肉腫脹するわけでもないので、歯肉腫脹の有無で白血病かどうかは鑑別できない。 白血病の症状は、と慢性白血病では大きく異なる。 急性白血病の症状としては、骨髄で白血病細胞が増加し満ちあふれるために正常な造血が阻害されて正常な血液細胞が減少し、正常な白血球の減少に伴い細菌などの感染症(発熱)、赤血球減少()に伴う症状(倦怠感、動悸、めまい)、血小板減少に伴う易出血症状(歯肉出血、鼻出血、皮下出血など)がよく見られ、ほかにも白血病細胞の浸潤によるのや、時には(特にAML-M3では)大規模な出血もありうる。 さらに白血病が進行し、各臓器への白血病細胞の浸潤があると、各臓器が傷害あるいは腫張し圧迫されてさまざまな症状がありうる。 腫瘍熱、骨痛、歯肉腫脹、肝脾腫、リンパ節腫脹、皮膚病変などや、白血病細胞がに浸潤するとやなどのさまざまな神経症状も起こりうる。 急性リンパ性白血病では、リンパ節・肝臓・脾臓の腫大や中枢神経症状 はよく見られるが、AMLでは多くはない。 ただし、これらの諸症状は白血病に特有の症状ではなく、これらの症状を示す疾患は多い。 ゆえに症状だけで、白血病を推定することは困難である。 慢性骨髄性白血病では、罹患後しばらくは慢性期と呼ばれる状態が続き、特に症状が現れず、で白血球数の異常が指摘され、初めて受診することも多く、慢性期で自覚症状が現れる場合は、脾腫による腹部膨満や微熱、倦怠感の場合が多い。 ただし、慢性骨髄性白血病の自然経過では、数年の後必ず、移行期と呼ばれる芽球増加の中間段階を経て急性転化を起こす。 急性期では芽球が著増し、急性白血病と同様の状態になる。 リンパ節の腫れ以外に、自覚症状がある場合には倦怠感、による腹部膨満 や、発熱、皮膚病変 などが見られる。 慢性リンパ性白血病の低リスク群では、無症状のまま無治療でも天寿を全うすることもあるが、病期が進行してくると、や減少が進み、やなどのや、を伴うこともある。 検査 [ ] 白血病の検査では血液検査とが主になる。 白血病の本体は骨髄にあり、白血病の状態を正確に把握するには骨髄検査が不可欠であるが、骨髄検査は患者にとって負担の多い検査であり、患者への負担が少ない血液検査も重要になる (骨髄と血液を川に例えると水源が骨髄で川の水が血液に相当する。 水源の異常は川の水質や水量に影響を与える。 川の水の状態から水源に異常があることはある程度推測することはできるが、水源の状態や何が起きているのかを正確に把握するには水源そのものを調べるしかない。 しかし水源まで行くことは苦痛を伴い労力が必要なので川の水の状態をこまめに点検し、必要に応じて水源の再点検も行うことが大事になる)。 血液検査()でを明らかに認めれば白血病の可能性は高い。 末梢血で芽球が認められなくとも、白血球が著増していたり、あるいは赤血球と血小板が著しく減少し非血液疾患の可能性が見つからなければ、骨髄検査が必要になる(白血病では白血球は、著増していることもあれば正常あるいは減少していることもある。 10万を超えるような場合以外は白血球数だけでは白血病かどうかは分からない)。 骨髄で芽球の割合が著増していたり、極端な過形成 であればやはり白血病の可能性は非常に高い。 急性白血病の骨髄では芽球の増加を認め、WHO分類では骨髄の有核細胞のなかでの芽球の割合が20%以上であれば急性白血病と定義するため骨髄検査を行わないと診断を確定できない。 さらに骨髄内の有核細胞中のMPO陽性比率や非特異的エステラーゼ染色や免疫学的マーカー捜索によって急性白血病中の病型の診断を確定させる。 CMLやCLLでも骨髄でのそれぞれの特徴的な骨髄像の確認は重要であり、CMLではの捜索を行う。 また、白血病細胞の中枢神経への浸潤の可能性や脾・肝臓腫、感染症などの白血病の症状を探るための諸検査(CT検査、脳脊髄液検査、細菌培養検査など)も行われる。 急性白血病細胞は多くの場合、白血球の幼若な細胞と類似した形態を取るため、あるいは芽球様細胞と呼ばれる。 血液細胞は大きくは、白血球、赤血球、血小板の3種に分けられるが、白血病細胞(芽球)は赤血球や血小板と違って有核であり、また赤血球と違い溶血剤に溶けず血小板とはサイズが違うため、正常な白血球ではないが自動血球計数器で分析する血液検査の血液分画(血液細胞の分類とカウント)の中では白血球の区分に入れられる(高性能な検査機や検査技師が行う目視検査では血液細胞の種類ごとに細かく分類ができる)。 急性白血病の血液検査ではヘモグロビンや血小板数は低下していることが多く、芽球が認められることが多い。 血液中の有核細胞が多数の骨髄系芽球と少数の正常な白血球だけで中間の成熟段階の細胞を欠けば()急性骨髄性白血病の可能性が高く 、リンパ芽球が多数現れていれば急性リンパ性白血病の可能性が高い。 芽球から成熟した白血球まで含めた白血球総数は著明に増加していることが多いが、なかには正常あるいは減少していることもある。 慢性骨髄性白血病では、血液、骨髄の両方で芽球から成熟した細胞まで白血球の著明な増加があり血小板も増加していることが多く、慢性リンパ性白血病では成熟したリンパ球が著明に増加する。 急性白血病細胞は分化能を失い幼若な形態(芽球)のまま数を増やすため、骨髄は一様な細胞で埋め尽くされる。 慢性白血病では細胞は分化能を失わずに、しかし正常なコントロールを失って自律的な過剰な増殖を行うため正常な骨髄に比べて各成熟段階の白血球系細胞が顕著に多くなる(過形成)。 骨髄検査では各細胞を細かく分けてカウントし、特に芽球の割合と形態が重要になる。 赤芽球は通常では芽球には含まれないが、赤白血病(AML-M6)では白血病細胞の半数程度はと同様の表面抗原を発現するため、赤白血病を疑われたときのみ、芽球に赤芽球を含める。 more than 11 世界のどの民族でも多い急性骨髄性白血病では、世界平均のは10万人あたり年間2. 5 - 3人といわれ、日本よりやや低くなっている。 若い患者もいる白血病といえども高齢者ほど罹患率は高いため、高齢人口割合が高くなると白血病の罹患率も高くなる。 また、慢性リンパ性白血病は欧米では急性骨髄性白血病と並んで多い白血病だがアジアでは少なく 、成人T細胞白血病はカリブ海諸国、アフリカ中部大西洋沿岸諸国、および日本で見られる など、地域・民族によって白血病発症の特性は違う。 白血病全体ではアジア人よりも欧米人の方が罹患率は高い傾向があるなど、白血病の罹患率は民族や年齢、性別によってその内容は異なる。 なお、その病気に罹ったら「罹患」、症状が出たら「発症」と区別されるが、急性白血病の場合は罹患率と発症率には大きな差はない。 アメリカには多様な人種・民族が暮らしているため、国ごとに違う生活環境による影響を排除して人種・民族ごとの遺伝学的な白血病の特性がある程度推定できる。 8人 、合計で年間に人口10万人あたり約6人程度と見られている。 つまりALLでは小児が多く、AMLでは大多数が成人で発症年齢中央値が60歳である。 慢性骨髄性白血病の発症率は10万人あたり1 - 1. 高齢者人口が1997年より増えた2005年の日本の統計では、高齢化によって白血病も増えており、2005年国立がん研究センターの統計では、日本では年間9,000人が白血病に罹患し、人口10万人あたり7. 1人の罹患率となっている。 そのうち男性が約5,300人、女性が約3,700人で、男性の10万人あたり罹患率は8. 3人、女性では5. 9人となっている。 2005年の日本では、67万6,000人が新たにがんに侵され、人口10万人あたりでは年間529人のがん罹患率で、白血病は全がんの1. 地域別では九州・沖縄で白血病が多いが、これは地域特性のある(後述)の発症率の差によるものである。 白血病幹細胞が発生してすぐに白血病の症状が出るわけではない。 1個の白血病幹細胞はゆっくりと、しかし自律的に増加して(コントロールを受けない)多数の白血病細胞を生み出していき、その白血病細胞は不死化(細胞寿命の延長)しているため、やがて骨髄を白血病細胞が占拠し満ちあふれる。 骨髄を白血病細胞に占拠され、正常な造血細胞が締め出されて正常な造血が阻害され、また骨髄に収まりきれず血液中にあふれ出た白血病細胞が各臓器に浸潤して白血病の諸症状が起きる。 遺伝子異常が起きる原因として被曝、や、抗がん剤など一部の化学物質、HTLVウイルスなどは発症のとされているが、それらが原因と推察できる白血病はごく一部に限られ、白血病のほとんどは原因は不明である。 白血病は親から子への遺伝もなく、成人T細胞白血病をわずかな例外とすればうつることもない。 ほとんどの白血病はウイルスなどの病原体によるものではないが、例外的に2種類だけが関わっているものがある。 ひとつは日本で同定されたで、のひとつ-Iの感染が原因であることが明らかになっている。 もう一つは急性リンパ性白血病バーキット型(FAB分類 ALL L3)の中でアフリカなどのマラリア感染地域に多い風土病型といわれるタイプでとの関連が指摘されている。 細かく分類すると数十種類に及ぶ白血病では判明している遺伝子異常の数は多いが、すべての白血病に共通する遺伝子異常は見つかっておらず、多数ある白血病の病型のうち慢性骨髄性白血病やなどいくつかの白血病では主となる遺伝子異常は判明しているが、大半の白血病では多くの遺伝子異常は見つかっていても共通で決定的な原因となる遺伝子異常は明らかでない。 白血病を含む「がん」は細胞の増殖・分化・生存に関わる重要な制御遺伝子に何らかの(染色体の転座、重複、部分あるいは全体の欠失、染色体上の遺伝子の点状変異など)異常が起こり、の発現との異常・抑制などいくつかの段階を踏んでがん化すると考えられている。 一般に白血病をふくめて「がん」は一段階の遺伝子異常だけでは起こらず、何段階かの遺伝子異常が積み重なってがん化するため、若い人では少なく、異常が積み重なる時間を十分に経た高齢者で多い。 遺伝子に変化が起きる原因としては活性酸素、ウイルス、放射線、化学物質などが考えられる。 がんを起こす遺伝子異常は染色体に活性酸素、ウイルス、放射線、化学物質などが作用することによって発生するが、細胞には遺伝子に生じた異常を修復する仕組みがあり、また修復しきれない致命的な異常が起きてしまったときはその細胞は死ぬが()、修復が効かずアポトーシスも免れるような変異を起こすことがある。 そのような遺伝子変異を起こした細胞のほとんどはキラーT細胞やナチュラルキラー(NK)細胞のような免疫系が正常細胞との表面抗原の違いを認識して破壊するが 、遺伝子異常を起こした細胞の中にキラーT細胞やNK細胞に認識される表面抗原の発現を変化させて免疫細胞による排除を免れるものがいる。 そのような遺伝子異常を積み重ねたのががん細胞であり、数を増やしてがんを発症させる。 造血細胞ががん化したものが白血病である。 を含むがん細胞は多段階の遺伝子異常を経て発生するが 、がん細胞ではアポトーシス制御に異常が起き、アポトーシス抵抗性を獲得する。 分類 [ ] 白血病における急性、慢性は一般的に用いる意味とは違っている。 造血細胞が腫瘍化して能を失い、見た目が幼若な血液細胞の形態の白血病細胞ばかりになる、白血病細胞が分化能を保っているもの(つまり一見まともな白血球が作られているもの)を慢性白血病と呼ぶ(ただし、慢性白血病の白血病細胞は見た目は正常な白血球に見えても、その機能には異常が生じ本来の役目は十分には果たせないものが多い)。 慢性白血病が急性化することはあっても、急性白血病が慢性白血病になることはない。 また、白血病細胞の性質が骨髄系の細胞かリンパ球系の細胞かによって骨髄性白血病、リンパ性白血病に分類する。 このことから主として以下の4種類に分類される。 (acute myelogenous leukemia; AML) 細胞の形態・性質を重視するではM0からM7までの8タイプに分けられ、さらにいくつかの細分類がある。 FAB分類は2011年現在も有用な分類ではあるが、遺伝子変異に関する知見など新しい知見により、WHOによって新分類が策定されている。 特異的染色体相互転座を有する急性骨髄性白血病• 染色体11q23異常を有する急性骨髄性白血病:FAB分類の11q23異常を有するM5• 多血球系異形成を伴う急性骨髄性白血病• 骨髄異形成症候群から転化した急性骨髄性白血病• 多血系異形成を伴う初発の急性骨髄性白血病• 治療に関連した急性骨髄性白血病と骨髄異形成症候群• 上記以外の急性骨髄性白血病 (chronic myelogenous leukemia; CML) 各白血病はさらに細かく細分されるが、慢性骨髄性白血病だけはほぼ単一の疾患概念となっている(原因となる染色体異常が以外にはない)。 フィラデルフィア染色体のないは別の疾患群に分類されている。 (acute lymphoid leukemia; ALL) FAB分類ではL1 - L3までの分類になっていたが、現在ではALLに関してはFAB分類は有用ではない。 近年、ALLとリンパ芽球性リンパ腫は本質的には同じ疾患で、同じ細胞がおもに骨髄で増殖すればALL、増殖の場がおもにリンパ節ならリンパ腫であり、同じ疾患の別の側面を見ているだけだとして、WHO分類ではALLは急性白血病とは別にして、リンパ芽球性リンパ腫とともにリンパ系悪性腫瘍として括っている。 しかしながら、症候的(症状や検査所見)ではリンパ腫とALLは相違があり、むしろAMLとともに急性白血病として括ったほうが臨床的にはなじみやすい。 WHOのALLに含まれる急性リンパ性白血病は以下である。 前駆B細胞急性リンパ芽球性白血病(これは遺伝子異常によってさらに細分される)• 前駆T細胞急性リンパ芽球性白血病( 〃 )• バーキット白血病 (chronic lymphoid leukemia; CLL) 慢性リンパ性白血病の分類に関してはかなり難しい。 慢性リンパ性白血病には広義の慢性リンパ性白血病と狭義の慢性リンパ性白血病の定義があるが、狭義の慢性リンパ性白血病の細胞の増殖が末梢血・骨髄でおもに行われる場合はCLLだが、同じ細胞がおもにリンパ節で増殖するならば小リンパ球性リンパ腫とされ、狭義の慢性リンパ性白血病と小リンパ球性リンパ腫は本質的には同一の疾患が異なる側面を見せているに過ぎないとされる。 また、リンパ腫の白血化とリンパ性白血病も非常によく似ている。 そのため、WHO分類ではリンパ性白血病とリンパ腫の区別は取り払い 、特にリンパ腫との境目があいまいな成熟傾向を持つリンパ系白血病はWHO分類ではリンパ増殖性疾患として括っている。 ただし、これら患者数の多い上記4つ以外にもきわめて稀な急性混合性白血病や、類縁疾患と白血病の境にあり厳密には他の疾患グループに入れられている白血病(、や、、、、ほか)など もあり、それらを含めると白血病の種類はきわめて多い。 治療法 [ ] 現在の白血病の治療の基本は化学療法(抗がん剤)である。 白血病の治療では骨髄移植が知られているが、骨髄移植や臍帯血移植などの造血幹細胞移植療法は過酷な治療であり、治療そのものが死亡原因になる治療関連死も少なくはない。 また寛解に入っていない非寛解期に移植をしても失敗する可能性は高い。 そのために白血病の診断がついてもいきなり移植に入ることはなく、まずは抗がん剤による治療になり、その後は経過や予後不良因子によって移植の検討がされる。 寛解とは白血病細胞が減少し症状がなくなった状態、完全寛解とは白血病細胞が見つからなくなった状態である。 完全寛解には、顕微鏡観察で白血病細胞が見つからない血液学的寛解と、顕微鏡観察より鋭敏な分子学的捜索で白血病細胞が見つからなくなった分子学的完全寛解がある。 症状が出てAMLと診断された時点では患者の体内には10 12個(一兆個)もの白血病細胞があるが、血液学的完全寛解では10 9個(10億個)以下、分子学的完全寛解では10 6個(100万個)以下になる。 血液細胞の数は骨髄内の有核細胞だけでも数千億個はあるため、100万個の白血病細胞といえど容易に見つかるものではない。 白血病細胞を(実験用に特別に作られた免疫のない)に移植する実験 ではたった1個の白血病細胞が白血病を引き起こすことが証明されている。 実際にはたった1個で白血病を引き起こせる細胞は白血病幹細胞であるが 、病的細胞を1個でも残すと再発の可能性は否定できないため、急性白血病の治療では白血病細胞をすべて殺す(total cell kill)必要があると考えられている。 ただし、慢性白血病を中心に治癒を望まずに疾病を押さえつけていくことで生命予後とQOL(Quality of Life)の改善を図っていく方法も多い。 治療の結果、もっとも鋭敏な検査法でも白血病細胞が見つからない完全寛解になっても白血病が再発することがあるのは、骨髄の奥深く環境で休眠状態の白血病幹細胞が抗がん剤に耐えて生き延びるためである。 再発した白血病細胞は抗がん剤治療をくぐり抜けてきた細胞であるため非常に治療抵抗性が強く、通常量の抗がん剤療法、放射線とも効きにくいため命を落とす確率が高く、そのため再発した白血病あるいは経験的に再発が予想されるタイプの白血病では、もっとも強力な治療である骨髄移植や臍帯血移植などのが適用となることが多い。 造血幹細胞移植では致死量をはるかに超えた大量の抗がん剤と放射線 によって、白血病幹細胞を含めて病的細胞を一気に根こそぎ死滅させることを目指す(前処置という)。 しかし、この強力な前処置によって正常な造血細胞も死滅するため患者は造血能力を完全に失い、そのままでは患者は確実に死亡する。 そのために型の一致した健康人の正常な造血幹細胞を移植し、健康な造血システムを再建する必要がある。 白血病の移植では大半を占める同種(家族を含めた他人からの)移植 では移植した免疫細胞(主としてリンパ球)による白血病細胞への攻撃(Ggraft versus leukemia effect:GVL効果)がある。 同種移植には時には死につながる大きな副作用()もあるが、代わりに万が一前処理後にも生き残った白血病細胞があってもGVL効果によって排除されることを期待できる。 ただし、それでもなおかつ再発することはある。 自家移植の場合は副作用GVHDはないもののGVL効果は期待できず、白血病細胞の混入もありえるため再発率は同種移植に比べて高く 、白血病の治療としては自家移植は少ない。 前処置では患者の免疫を破壊して移植した造血幹細胞が拒絶されない働きもする。 しかし、通常の移植の前処置はあまりに強力な治療であるため、体力の乏しい患者や高齢者は治療に耐えられない。 そのためという手段もある。 ミニ移植では前処置の抗がん剤投与や放射線治療はあまり強力にはしない。 そのために白血病幹細胞は一部は生き残る可能性は高いが、GVL効果(移植した正常な造血による免疫とによるドナー由来リンパ球の免疫によって残った白血病幹細胞が根絶されること)を期待する。 ただし、ミニ移植でもかなり強力な治療には違いないため、すべての患者が適応になるわけではない。 ミニ移植は通常の移植(フル移植)に比べて移植前処置が軽いということであり、ミニと言っても移植の規模が小さいということではなく、移植後の副作用も小さいわけでもない。 ミニ移植では前処置の主たる目的は移植された造血幹細胞が拒絶されないようにすることになる。 急性骨髄性白血病の治療 [ ] 現在の急性白血病の基本の治療法は total cell kill(TCL)といい、最初に抗がん剤を使用して膨大な白血病細胞を減らして骨髄に正常な造血細胞が増殖できるスペースを与え(初回寛解導入療法)、その後の休薬期間に空いた骨髄で正常な造血細胞が増えるのを待ってから、さらに間歇的に抗がん剤を使用すること(地固めおよび強化療法・維持療法)を繰り返して最終的に白血病細胞の根絶を目指す治療を基本とする。 急性骨髄性白血病では最初の治療(寛解導入療法)として アントラサイクリン系抗がん剤(ダウノルビシンあるいはイダルビシン)3日間あるいは5日間と抗がん剤シタラビン(キロサイド)7日間の併用療法 が一般的である(急性前骨髄球性白血病(AML-M3)は例外である。 AML-M3については後述)。 これでほとんどの患者では寛解にもっていける。 しかし、血液学的に白血病細胞が見られなくなっても白血病の大本である白血病幹細胞は隠れて存在し、そのままでは白血病が再発するため、寛解導入療法後に一定期間が経ち正常な造血が回復してきたら、隠れた白血病幹細胞の根絶を目指す地固め療法を行う。 地固め療法ではアントラサイクリン、シタラビンに加え、白血病細胞が薬剤耐性を持たないように違う種類の抗がん剤(エトポシドやビンカアルカロイド)を加えた併用化学療法を使ったり、シタラビンの大量療法を行い 、通常は1クール4週間程度の地固め療法を3、4回繰り返し白血病細胞の根絶を目指す。 強化療法で白血病細胞の根絶ができたと期待できても、万が一生き残っている白血病細胞があると再発する可能性があるため、強化療法終了後(退院後)にも定期的に抗がん剤投与を行い、万が一の可能性を押える維持療法を行うこともある。 ただし、日本では強化療法を十分に行うことにより維持療法は不要とする施設も多い。 完全寛解の状態が5年続けば再発の可能性は低く、治癒と見なしてよいとされている。 急性白血病では、急性前骨髄球性白血病(AML-M3)のみ治療法はまったく異なり、(ATRA)による分化誘導療法と抗がん剤の併用療法が用いられる。 オールトランスレチノイン酸を与えると、分化障害を持っていた急性前骨髄球性白血病細胞はATRAによって強制的に分化・誘導させられ、継続的に白血病を維持する能力を失ってしまうのである。 この薬剤の登場により、M3はAMLの中でもっとも予後良好な群となった。 ATRA単剤では再発が多いため、ATRAと抗がん剤アントラサイクリンを併用した寛解導入・地固め・強化維持療法が行われ多くの患者が治癒している。 ATRA治療後に急性前骨髄球性白血病(AML-M3)が再発してしまった場合には、機序は違うが、やはり細胞を分化誘導とアポトーシスに招くが著効することが知られている。 急性リンパ性白血病の治療 [ ] 急性リンパ性白血病では白血病細胞はによく反応し数を減らし、またAMLに比べて使用できる薬剤は多いが、治療の基本的な考え方は急性骨髄性白血病と同じである。 急性リンパ性白血病の寛解導入(初回の治療)ではビンクリスチン(VCR、商品名オンコビン)とプレドニゾロン(プレドニン)およびアントラサイクリン系抗がん剤の組み合わせを基本とし、それにシクロホスファミド(エンドキサン)やL-アスパラキナーゼ(ロイナーゼ)などを加えることもある。 どのプロトコール(薬剤の組み合わせや各薬剤の投薬量・投薬スケジュール)がいいかは一概には言えず、標準治療は存在しない (上に挙げた薬剤でプレドニゾロンは抗がん剤ではなくステロイドである)。 寛解導入後に行われる地固め療法もさまざまなプロトコールがあるが、寛解導入とは組み合わせを変えるのが基本となる。 なるべく多種類の薬剤を使用したり、シタラビン(キロサイド)大量療法などがある。 ALLでは白血病細胞が中枢神経を侵しやすく、予防しないと中枢神経白血病になることがあり、放射線の頭蓋照射や抗がん剤の髄注あるいはシタラビンなどの大量投与などを組み合わせて予防する。 小児ALLでは、化学療法だけで長期生存する確率が高いため、第一寛解期で移植を検討することは少ない。 しかし、成人のALLでは再発率が高いため、AMLに比べると第一寛解期での移植を検討することは多い。 移植を行わない場合、ALLでは寛解導入療法と地固め療法を数コース行って完全寛解し、いったん退院したあとにも、定期的に化学療法(おもに経口抗がん剤やプレドニゾロン)を行う維持療法を長く(2年程度)行う。 慢性骨髄性白血病の治療 [ ] 慢性骨髄性白血病については従来はインターフェロンが一部には有効ではあったが、インターフェロンが効かない場合は移植治療以外には、単に延命を計るだけの治療しかなかった。 しかし、2001年分子標的薬の登場で様相が一変した。 グリベックは慢性骨髄性白血病細胞において遺伝子変異によって作られた異常なBcr-Abl融合タンパク(自己リン酸化して常に活性化し、シグナル伝達を行う基質をリン酸化し、それはさらに下流の細胞の分裂を促す細胞内シグナル伝達系を活性化させていく酵素(チロシンキナーゼ)でこのため、白血病細胞は自律的に増殖する )が異常な細胞分裂を促すシグナルを伝達するのを阻害する薬で、活動している慢性骨髄性白血病細胞にのみに的を絞って攻撃し、正常な細胞は攻撃しないので副作用の少ない画期的な抗がん剤(分子標的薬)である。 慢性骨髄性白血病の Bcr-Abl遺伝子変異にも様々なサブタイプ(変異体)があり、中にはグリベックが効かない Bcr-Abl変異体もあるが、同様な分子標的薬が次々に開発され、Bcr-AblタンパクT315I変異体という治療抵抗性の強いサブタイプの1つを除いては慢性期の CML はほぼ押さえ込むことができるようになっている(ただし、分子標的薬は休眠している白血病幹細胞には届かないため、病気を抑えることはできても、治癒は必ずしも望めない)。 慢性骨髄性白血病では急性白血病のような休薬期間はなくグリベックなどの分子標的薬を飲み続けることになる。 グリベックなどの分子標的薬に治療抵抗性のある CML、あるいは治療の過程で治療抵抗性を持ってしまった CML では造血幹細胞移植が推奨される。 また付加的な遺伝子異常が起きてしまい芽球が増加し始めた移行期の治療ではグリベックの増量や他の分子標的薬に変更したり、あるいは造血幹細胞移植も検討する。 さらに芽球が増えて骨髄、末梢血中の芽球が30%以上になる急性期では、芽球がリンパ系ならば ALL に準じた治療に加えて分子標的薬を投与し、芽球が骨髄系ならば AML に準じた治療に加えて分子標的薬を投与するが、急性期に移行した場合には抗がん剤も分子標的薬も有効とも限らず移植医療を検討する。 慢性リンパ性白血病の治療 [ ] 「」も参照 狭義の慢性リンパ性白血病は進行が緩慢で無治療でも天寿を全うすることができる患者も少なくなくによって治療手段が違い、リンパ球の増加のみで症状がなく安定している場合は治療によって生命予後が改善されるとは限らない。 そのため状態がリンパ球の増加のみであるならば無治療で経過観察を行い、病期が進み、リンパ節腫大や脾肝腫、貧血、血小板減少などが現れてくると治療の対象になる。 近年では狭義の慢性リンパ性白血病には進行がゆっくりで無治療でよい群と進行が早く治療の必要な群の2群があることが判明しつつあり、遺伝子研究が進んでいる。 治療は以前にはシクロフォスファミドが使われていたが、現在ではフルダラビン単剤、もしくはフルダラビンとシクロフォスファミドの併用が標準であり、リツキシマブの併用も有効性が認められている。 ただし、治癒は望めず治療の目的は病勢のコントロールと生存期間の延長を図ることである。 抗がん剤の副作用と対策・支持療法 [ ] 浅野他監修『三輪血液病学』(文光堂、2006年、p. 630)より 白血病の治療では主に抗がん剤を使う。 白血病の多くは症状が厳しく急を要し難治なので治療も強いものにならざるをえず、白血病細胞が薬剤耐性を持たないようにするため抗がん剤は多剤を併用することが標準である。 もともと白血病特に急性白血病では正常な血液細胞が減ることが多く、感染症、貧血症状、易出血傾向などが見られるが、抗がん剤では骨髄が抑制(造血細胞が抗がん剤で減少する)されるので感染症、貧血症状、易出血傾向はさらに悪化することが多い。 そのために感染症対策や、赤血球や血小板の輸血、時には投与などは重要になる。 抗がん剤の副作用はさまざまであるが、主なものを右に挙げた。 急性骨髄性白血病の治療で用いられることが多いシタラビン(Ara-C, キロサイド)では骨髄抑制、嘔気・嘔吐、下痢、脱毛、肝・腎機能障害などに加えてシタラビンの特徴としてや脳の障害が見られることがある。 シタラビン大量療法ではステロイド点眼薬が必要になる。 やはり急性骨髄性白血病で用いられることが多いアントラサイクリン系の抗がん剤では骨髄抑制、嘔気・嘔吐、脱毛などの他にアントラサイクリン系特有の心臓への毒性がある。 急性リンパ性白血病で使われるビンクリスチン(オンコビン)では抗がん剤に共通する副作用の他に神経毒性、ひどい便秘や腸閉塞、低ナトリウム血症などの電解質異常(抗利尿ホルモン不適切分泌症候群) などがある。 シクロフォスファミド(エンドキサン)では出血性膀胱炎が特有の副作用であり、大量の水分の補給で尿を増やし濃度を薄め早く薬剤を排出させることが必要になる。 また、抗がん剤そのものの作用ではないが、治療開始初期には抗がん剤によって大量の白血病細胞が死ぬために白血病細胞の内容物が血液内に一気に放出され高尿酸血症や高カリウム血症、低カルシウム血症などが起き、それによって腎不全に陥ることがある。 これを腫瘍崩壊症候群(急性腫瘍融解症候群)と言い、適切な対処をしないと死に至ることもある。 また、抗がん剤の代謝、排出器官である肝臓と腎臓に障害があると毒性は一層顕著になるので、臓器に障害がある際には特に注意が必要である。 患者、特に女性患者にとって切実な副作用は脱毛であるが、抗がん剤治療が終れば髪は復活する。 個人差はあるものの抗がん剤を使用したその日から脱毛が始めるのではなく抗がん剤を開始してから2-3週間程度で脱毛は始まる。 脱毛は頭髪だけでなく全身の毛でも起こりうるが、抗がん剤治療を終了して1-2か月ほどで毛髪は再生し始め、約半年ほどで再生する。 再び生えてきた毛髪は抗がん剤治療の前よりは少し細く、質も変わることもあるが2年ほどで髪質も元に戻る。 副作用への対策・支持療法 [ ]• 感染症対策。 白血病では異常な白血球が増加することはあっても正常な白血球は減少している。 さらに抗がん剤の投与で正常な白血球は一層減少するために、細菌や真菌に感染しやすい。 そのため、発熱があったら感染症を疑って検査を行い、病原体にあった抗生物質や抗真菌剤を投与する。 また、白血球数を増加させるために造血因子製剤(顆粒球コロニー刺激因子 G-CSF)が投与されることがある。 白血病や抗がん剤の副作用のために貧血や血小板減少による出血傾向が強くなったら赤血球の輸血や血小板の輸血が行われる。 吐き気。 抗がん剤治療の副作用である吐き気や嘔吐は最も苦痛の強い症状の一つといわれる。 吐き気や嘔吐に対しては制吐剤が使われる。 腎臓障害。 腎臓に障害が発生すると薬剤の排出が遅れ抗がん剤の毒性が一層顕著になる。 そのため腎臓障害があるときは減量が必要になる。 また、腎臓を守るために飲水や輸液と利尿剤によって速やかに抗がん剤を排出させてやることが必要なこともある。 また、シクロフォスファミドでは排出された抗がん剤が膀胱に炎症を起こすため、尿中の薬剤濃度を薄め、また速やかに排出できるように特に大量の水分の投与がされる。 将来の治療法 [ ] 従来の治療法は白血病細胞をすべて殺す、押えつけることを念頭においていたが、白血病幹細胞の研究の進歩及び急性前骨髄性白血病での分化誘導療法の開発によって、治療の考え方が根本的に変わろうとしている。 急性前骨髄性白血病での分化誘導療法では白血病幹細胞を含めて白血病細胞を強制的に分化させてしまう方法である。 殺すのではなく、白血病細胞特有の性質を除去するのである。 現在は白血病幹細胞の研究が進み、白血病細胞の中でわずかな白血病幹細胞のみが無限の増殖能を持ち、末端の白血病細胞は有限の増殖しかできないことが判明している。 したがって白血病幹細胞の除去さえできれば、末端の白血病細胞は残しても白血病はやがて治癒するものと考えられるようになっている。 ただし、現在の技術では末端の白血病細胞よりも白血病幹細胞を除去するほうが難しいが、将来的には、今の total cell kill療法に代わり、白血病幹細胞に的を絞った治療法の開発が本命になっていくと考えられている。 白血病幹細胞 [ ] 急性白血病細胞の増加 血液細胞の大本であるは極めて少数で、それ故に貴重でありその多くはで支持細胞に守られながら休眠している。 造血幹細胞は造血が必要なときに目覚めさせられ、2つに分裂し、1つは元の幹細胞と同じ細胞であり(自己複製)再び眠りに付くが、もう1つは分化の道をたどり始めて前駆細胞となり(分化の道をたどり始めた細胞は自己複製能力はなくなる)盛んに分裂して数を増やしながら分化・成熟して極めてたくさんの血液細胞を生み出していく。 急性白血病においても幹細胞と末端の細胞の関係は同様であると考えられている。 正常な造血幹細胞もしくは前駆細胞の遺伝子に変化が起こり、細胞の分化能に異常が起き、また細胞に不死化(細胞寿命の延長)をもたらすものが白血病幹細胞である。 正常な造血幹細胞はの構成細胞や造血因子のコントロール下にあり自律的な増殖はしないが、白血病幹細胞は造血因子の有無に関係なく増殖(自律的増殖)する。 ニッチにおいて正常な造血幹細胞はほとんどが休眠期 の)にあるが、白血病幹細胞においては(休眠期に入っている細胞も少なくないが)正常な造血幹細胞に比べて細胞分裂のに入っている細胞の割合は高いと考えられている。 少数の正常な造血幹細胞が自分自身を保持しながら、極めてたくさんの血液細胞を生み出すのと同じに、白血病幹細胞も自分自身を保持しながら、極めてたくさんの白血病細胞を生み出していくのである。 ただし、白血病幹細胞から生み出された細胞は決して正常な血液細胞になることはできずに増殖し、正常な造血を阻害するのである。 急性白血病の中には正常な造血前駆細胞が遺伝子異常とともに自己複製能を再獲得して白血病幹細胞が発生するものもあると考えられている。 最新の知見では急性白血病の幹細胞はむしろ、そのほとんどは造血前駆細胞が遺伝子変異(分化障害と細胞寿命の亢進・自己複製能の再獲得)を起こしたものと考えられている。 正常な造血細胞に遺伝子変異が起こり急性白血病幹細胞は発生するがその遺伝子変異は1段階ではなく、増殖・生存能の亢進をもたらす遺伝子変異と細胞の分化障害を起こす遺伝子変異など複数の段階にわたる遺伝子異常が重なって発症すると考えられている。 細胞の増殖・生存能が亢進する変異はクラスI変異と呼ばれ、細胞の増殖や生存に関わるシグナル伝達の活性化-増殖亢進、細胞寿命の亢進などが起き、これが前面に立つと様の自律的増殖能を亢進する。 クラスII変異とされる分化障害が先行すると様の細胞形態の異常が起き、急性白血病ではこのクラスI・クラスIIの変異の少なくとも2段階の遺伝子変異が必要である。 このクラスI変異、クラスII変異の遺伝子異常の種類はそれぞれ多様で、なおかつ複数の変異が重複することもあり、さらに付加的な遺伝子異常もあり、白血病にきわめて多数のサブタイプがありそれぞれ性質が異なっているのも、遺伝子変異の多様性のためである。 慢性白血病でも造血幹細胞に遺伝子異常がおき、正常なコントロールを脱して異常な増殖をするが、慢性白血病では細胞の分化能は失われておらず成熟した多数の細胞を生み出す。 慢性白血病幹細胞が生み出す血液細胞は一見正常な細胞と同様に見えるが、やはり細かく見ると正常な細胞とは必ずしも同じではない。 慢性骨髄性白血病 CML において、マウスの正常な造血幹細胞に CML の原因となる「がん遺伝子」BCR-ABL融合遺伝子を導入するとマウスは CML を発症する。 しかし、造血幹細胞から分化が進み、盛んな増殖能は持つが自己複製能は失った造血細胞に BCR-ABL融合遺伝子を導入してもマウスは CML を発症しないことも分かっている。 がん遺伝子 BCR-ABL融合遺伝子は細胞の増殖能力の自律的亢進に関わるが、細胞の自己複製能を発現するものではないことが分かる。 CML幹細胞も造血幹細胞と同じくニッチ環境にあり、その多くは細胞活動が停止した休眠期(細胞周期G0期)にあると考えられている。 イマチニブなどの Bcr-Ablタンパクを標的にした分子標的薬は休眠している細胞には届かないと考えられている。 白血病細胞の分裂・増殖速度 [ ] 症状が出るまでに進行した白血病では短時間で末梢血の白血球や芽球の数が増加することが多く、白血病細胞は増殖が速い印象がある。 しかし実際には白血病細胞は、正常な造血細胞に比べ細胞分裂(増殖)が早いわけではなく、むしろかなり遅い。 正常な造血細胞と比べ慢性白血病細胞の分裂には2-4倍の時間が掛かり、名に反して急性白血病細胞ではさらに細胞分裂には時間が掛かるのである。 しかし、正常な造血細胞の細胞分裂の開始はコントロールを受け、造血細胞が増殖を始めても細胞はやがて分化・成熟して末梢血に移り役割を果たして寿命を迎え、また、過剰に作られた細胞はコントロールを受けてを迎えるので、健康人の正常な血液細胞は一定の数を保つのだが、白血病細胞はコントロールを受け付けることなく無際限に増殖し、また白血病細胞は不死化(細胞寿命の延長)しているので最終的には正常な細胞を圧倒して増殖する。 このようにして白血病細胞は正常な造血細胞を圧倒して骨髄を占拠し、さらには血液(末梢血)にもあふれ出てくる段階(通常、自覚症状が明らかに現れるところまでくると)になると骨髄での白血病細胞の数はすでに膨大なものになっているので、細胞1個の分裂時間は長くとも、末梢血内では短時間の内にみるみる白血病細胞の数が増えていくようになる。 年齢による白血病の違い [ ] 小児白血病 [ ] 小児白血病の疫学 [ ] 小児の白血病は欧米では年間小児10万人あたり4人 、アジアではやや少なく日本では年間10万人に3人程度発症する。 日本の小児科では年間700-800人ほどの小児が白血病を発症し小児科で治療を受けている。 35)のは成人と同じである。 成人では急性骨髄性白血病 AML が多いので成人と小児ではリンパ性:骨髄性の割合が逆転している。 小児の白血病では AML は年齢を問わず発症しているが、ALL では2-3歳の男子に発症が多い。 白血病の原因となっている遺伝子変異の種類は多いが、年齢によってよく見られる遺伝子変異の種類は異なり、2-9歳の小児では予後の良いタイプの遺伝子変異が多く、1歳未満の乳児を除くと年齢が低いほど予後が良いタイプの白血病の割合が多くなる傾向にある。 ただし、小児白血病は予後が良いものが多いといっても重篤な疾患であることにかわりはない。 人数的に小児白血病の大半を占める2-4歳児の白血病には予後の良いタイプの ALL(高2倍体あるいはTEL-AML1融合遺伝子)が多いが、全体の中では少数である年長児の白血病では予後の良いタイプの ALL の割合は少なくなり、10歳以上の白血病はハイリスク白血病と見なされる(ただし成人の ALL より悪いということではない)。 しかし、なかには、2-4歳児の白血病でも予後不良なタイプの白血病もあるので予後不良因子の見極めは重要である。 小児白血病の治療 [ ] 小児の ALL の治療では寛解導入療法・聖域療法・強化療法・維持療法の4相の治療を行う。 寛解導入療法ではと(商品名オンコビン)の2剤で寛解を目指す。 ALL では中枢神経に白血病細胞が浸潤することが多く、中枢神経白血病の予防あるいは治療のために聖域療法としての髄注や大量投与、場合によっては頭蓋放射線照射などが行われる。 残存している白血病細胞の根絶を目指す強化療法では多剤投与や(キロサイド)大量投与などを行い、万が一生き残る可能性のある白血病細胞を押えるために維持療法として とメトトレキサートの内服を1-2年ほど続ける。 予後の悪いタイプや万が一再発してしまったときは移植医療を検討する。 小児では体が小さいので細胞数の少ない臍帯血や小柄な女性の骨髄でも移植に十分な数の造血幹細胞が得られるので成人に比べるとは得やすい。 小児の AML の治療は ALL ほど成績は良くないが寛解導入はシタラビン(キロサイド)とアントラサイクリン系抗がん剤を用い、強化療法・維持療法で完全寛解を目指す。 AMLでは中枢神経白血病は少ないので予防的な抗がん剤の髄注を行うことは少ない。 なお、上に挙げた薬剤はプレドニゾロン以外は抗がん剤である。 ダウン症小児白血病 [ ] の小児では種々の血液異常が起きることが多いことが知られているが、白血病も非ダウン症児の15倍の発症率を示す。 ダウン症の新生児では一時的に白血病に似た状態を呈することが多い。 そのほとんどは数か月で自然治癒するが、一部のダウン症児は急性巨核芽球性白血病 AML-M7 を発症する。 非ダウン児に比べると3歳未満のダウン症の小児では急性巨核芽球性白血病 AML-M7 になることは特異的に多い。 3歳以降のダウン小児では発症率も傾向も非ダウン症小児と同じになる。 高齢者の白血病 [ ] 子供や若者も発症する白血病だが、やはり高齢者の方が発症率は高い。 60歳の白血病発症率は年間10万人あたり5人だが、80歳では年間10万人あたり17人の発症率になる。 骨髄異形成症候群 MDS から移行した白血病は予後が悪い。 また、MDS の既往のない高齢者の白血病では若年者の白血病に比べて予後良好因子の白血病は少なく予後不良因子を持つものが多く 、なおかつ、高齢者では体力や回復力が衰えておりあまり強力な治療はできないことが多く治療は困難で、未だに高齢者に向けた標準的治療はない。 55歳以上の高齢者では移植はできないが(ミニ移植は適応になる)60歳以下あるいは60-64歳程度の比較的体力があると見られる患者では一般的な標準治療が選択されることが多く、逆に抗がん剤の強度を増した治療なども試みられていて効果があったとする報告も見られる。 しかしそれ以上の年齢の白血病患者では抗がん剤の効果が少ないことが多く、逆に早期の治療関連死は増える。 体力のない高齢者では治療関連死が多いため、強い抗がん剤では減薬して強度を低くし、あるいはのような弱い抗がん剤による治療、または支持療法が行われることも多いが、いずれにしても高齢者の白血病では長期生存率は高くはない。 しかし近年では強度を弱めた前処置による造血幹細胞移植が普及し知見が積み重なったことで従来は適応でなかった高齢者も移植の対象になりだしている。 その他の白血病 [ ] 典型的な白血病4分類 AML, ALL, CML, CLL 以外の白血病も存在する。 細かく挙げると数が多いので特異的なものを一部紹介する。 二次性(治療関連)白血病 [ ] 各種の癌や血液腫瘍の治療で抗がん剤や放射線治療を行った数年後に白血病や骨髄異形成症候群を発症する可能性が高くなることが知られている。 治療関連白血病(抗がん剤や放射線によってもたらされた白血病)は急性骨髄性白血病がほとんどであり tAML という。 tAML は化学治療で寛解に持っていっても早期に再発することが多く、造血幹細胞移植を積極的に検討する必要があるが、移植の成績も自然発生した AML に比べると良くはない。 抗がん剤もアルキル化薬によって引き起こされた白血病の場合は薬剤の投与から白血病発症までの期間は5-7年程度と長く、MDS の段階を経て急性骨髄性白血病になることが多く、予後は極めて悪い。 同じ抗がん剤でもトポイソメラーゼII阻害薬によって引き起こされる白血病は薬剤の投与から白血病を発症するまでの期間は2-3年でアルキル化薬による白血病よりは予後がまだしも良いが、やはり難治である。 また治療関連の CML や ALL も tAML ほど多くはないが報告されている。 治療関連の CML は tAML ほどには性質は悪くはないとされている。 成人T細胞白血病 [ ] 詳細は「」を参照 ほとんどの白血病はウイルスが原因ではなくうつることもないが、成人T細胞白血病は極めて例外的な白血病である。 日本に多く、1977年に日本人によって初めて報告された疾患であり日本で最も研究・解析が進んでいる。 HTLV-1 Human T-cell leukemia virus type-1 ウイルスによる白血病で、病型は急性型、慢性型、リンパ腫型、くすぶり型と症状・病態の違う発現をする。 HTLV-1ウイルスの感染および成人T細胞白血病の発症は地域差があり、世界ではカリブ海諸国、アフリカ中部大西洋沿岸諸国、及び日本でみられ、特に西南日本、とりわけ南九州と西九州で多い。 日本では100万人以上のキャリア(ウイルス保持者)がいるが、成人T細胞白血病の発症は年間600-700人程度であり、出身別では九州出身者が7割を占める。 ATL は日本の本州では年間人口10万人あたり0. 2-0. 3人と稀な病型だが、九州では人口10万人あたり2-3人で急性骨髄性白血病より若干多く、白血病の病型の中で最も多い。 HTLV-1ウイルスの感染ルートは輸血、性交による感染、母乳に限られ、現在では輸血用血液は検査されており、母子感染を別にすれば HTLV-1ウイルス感染者が近くにいても HTLV-1ウイルス感染者と性交さえしなければうつることはない。 性交で感染するため、ウイルス感染率は年齢が上がるほど上昇し、とくに女性の感染率が上昇する。 母子感染は人工ミルクに切り替えることで防げる。 ウイルス感染から白血病発症まで極めて長い時間(数十年)掛かり、そのため乳児のときにウイルスに感染しても成人T細胞白血病を発症するのは成人になってからであり、日本においては成人T細胞白血病患者の平均年齢は61歳である。 症状はさまざまであるがリンパ節腫脹、感染症による症状、皮膚病変などが多い。 リンパ腫型では末梢血や骨髄での白血球増加は目立たず、リンパ節腫脹を特徴とする。 慢性型とくすぶり型では大人しく、緩やかな経過をたどるためにすぐには治療を行わずに経過観察することが多い。 急性型とリンパ腫型ではきわめて多種類の抗がん剤とプレドニゾロンを組み合わせる治療が行われる。 若い(55歳以下)患者では骨髄移植などの造血幹細胞移植も検討される。 男性に多く、患者の平均年齢は50-55歳で中年以降に多い。 脾腫と汎血球減少が多く見られ、血球が減るだけでなく免疫を司る細胞に異常が多く、通常の感染症だけでなく非定型抗酸菌やカリニ肺炎、真菌症等の免疫不全によるが多く、感染症が死亡原因で目立つ疾患であるが、悪性度は低く進行がゆっくりで経過観察で良い症例も多い。 HCL は位相差顕微鏡で見ると白血病細胞が特異な形態を取るので診断はしやすい。 治療はインターフェロンやプリンアナログが著効する。 日本ではヘアリーセル白血病は極めて少ないが、日本のヘアリーセル白血病には日本型 Japanese variant というローカルな亜型が存在し、日本のヘアリーセル白血病患者のなかでは日本型が大半を占める。 ヘアリーセル白血病日本型は患者の平均年齢が64. 9歳と高く、普通の HCL が男性に圧倒的に多いのに比べ、日本型は女性にやや多く、白血球は増加していることが多い。 日本型はインターフェロンの効き目も良くない。 系統不明な白血病 [ ] 白血病は細胞の性質によって骨髄性とリンパ性に分けられるが、まれに白血病細胞の細胞系列のはっきりしない白血病(混合性白血病、あるいは急性未分化型白血病などの系統不明な白血病)がある。 系統不明な白血病には、骨髄系白血病細胞とリンパ系白血病細胞それぞれの2系統の細胞集団が同時に現れるものと、1つの細胞に骨髄系リンパ系の両方の特徴が現れるもの、白血病細胞に一切の分化傾向が見られない急性未分化型白血病などがある。 AML で最も未分化な最未分化型急性骨髄性白血病 AML-M0 でさえ骨髄系細胞の証である MPO は光学顕微鏡では認められないが電子顕微鏡レベルでは認められ他の手段でも骨髄系と判明するが、急性未分化型白血病の芽球では骨髄系の抗原の証である MPO が電子顕微鏡レベルでも陰性であり、他の手段でも骨髄系への分化傾向は認められず、なおかつリンパ系の抗原も一切発現していない。 白血病細胞の分化が幹細胞に極めて近いところで止まってしまっている細胞であると考えられる。 急性未分化白血病は幹細胞白血病とも呼ばれ、その白血病細胞の性質はほとんど幹細胞と同等の性質を持っている。 逆に言えば急性未分化白血病以外の白血病(ほとんどすべてになる)の細胞はわずかではあり異常でもあるがいくらかは分化したところで分化が止まった細胞であり、またその分化の方向で細胞の性質もある程度違ってくる。 これら系統不明な白血病は極めて稀であり、分かっていないことが多いが一般に予後不良といわれている。 低形成性白血病 [ ] 白血病は骨髄で白血病細胞(芽球)が自律的に増加する疾患であるが、一部では例外的に芽球割合は増加し異形成は見られるが絶対数は減少することもある(低形成性白血病)。 骨髄での芽球の絶対数が少ない低形成性白血病は白血病の定義からすると特異な病型であり FAB分類でも WHO分類でもカテゴリーになっていない、しかし、WHO分類では言及されている。 本来白血病とは正反対の疾患である再生不良性貧血に非常に似ているが再生不良性貧血と違って芽球の割合の増加が認められる。 主に高齢者の AML で見られるが、強い治療はできずシタラビン少量療法がよいとされている。 白血病と類縁疾患の境 [ ] 白血病自体、単一の疾患ではなく、その原因遺伝子、病態には様々なものがある。 さらに白血病の類縁疾患は数多くあり、その多くでは白血病と類縁疾患の境目は明瞭ではないため、以下に簡単に類縁疾患について記す。 MDS は、多くでは貧血を伴う造血障害と細胞の異形成を特徴とする血液疾患であるが、MDS の一部では骨髄において芽球が増加していることがある。 この前白血病状態の MDS の細胞では遺伝子異常によって細胞の分化障害が起こっていて芽球比率の増加が生じているが、これにさらに自律的増殖能力や不死化が加わると二次性の急性骨髄性白血病になると考えられている。 は白血球の1種リンパ球が悪性腫瘍化してリンパ組織での腫瘍的異常増加をきたす疾患だが、リンパ系白血球が腫瘍化した細胞が骨髄で増加するリンパ系白血病の細胞と悪性リンパ腫の細胞に免疫学的形質や遺伝子異常に本質的な差はないとされている。 悪性リンパ腫で腫瘍細胞が末梢血中に出現しさらに骨髄に腫瘍細胞が移動してそこで増殖を始めると、白血病の定義を満たしてしまい、白血病と言えてしまうこととなる。 悪性リンパ腫と白血病が区別できなくなると非常に困るので、そのような病態を悪性リンパ腫の白血化と呼ぶこととなった。 しかし、リンパ球にはリンパ節という増殖を行える器官があるため、非常に病態の解釈が難しい。 骨髄でリンパ系の白血病細胞が発生して、白血病となり後にリンパ節に浸潤したのか、リンパ節で細胞に異常が起こりそれが白血化し骨髄浸潤をしたのか区別できなくなるのである。 例えば慢性リンパ性白血病と小リンパ球性リンパ腫の細胞は本質的に同じものとされ、同じように急性リンパ性白血病である前駆B細胞リンパ芽球性白血病 B-ALL と前駆B細胞リンパ芽球性リンパ腫 B-LBL の細胞にも本質的な差はない。 しかしながら症候的にはリンパ系白血病とリンパ腫では明確な差があり、リンパ性白血病と悪性リンパ腫を一括りにすることは臨床的には必ずしも受け入れられているわけではなく、むしろ急性リンパ性白血病は急性骨髄性白血病とともに急性白血病で括ったほうが臨床的にはなじみやすい。 という骨髄でリンパ球系細胞の形質細胞が腫瘍化して増殖するのにもかかわらず、臨床症状からリンパ腫とも白血病とも区別されている疾患もある。 正常であれば炎症の局所やリンパ節・扁桃・脾臓といったいわゆるリンパ組織に分布するBリンパ球が分化した形質細胞が腫瘍化したものであるが、不思議なことにリンパ組織ではなく骨髄および骨に積極的に浸潤する。 リンパ腫という段階が生じているのかも不明である。 また、慢性骨髄性白血病などと同じに属するや、も主として増加している血球は白血球以外であるが、その本質は慢性骨髄性白血病などと同じく造血幹細胞レベルでの遺伝子異常による細胞の増殖能の自律的向上であると考えられ、一般的には白血病とはされないこれらも、広義には白血病の類として扱われることもある。 血液分画では好塩基球が増加し、好中球と、時には好酸球も増加する。 1945年、広島と長崎がでしたが、その放射線者では5年後の1950年から10年後の1955年にかけて慢性骨髄性白血病の発生頻度が著明に増加した。 被曝した放射線量が0. 5Gy 以上の放射線被曝者では通常の数十倍の慢性骨髄性白血病の発生が記録され 、原爆の被爆から5-10年後に発症はピークを迎え、その後には発症率は急激に低下し通常レベルになっている。 大まかな推移。 稲葉俊哉「放射線がんにおけるエピゲノム制御異常の役割」(『広島医学』Vol. 63 No. 4、2010年、pp. 236 - 240)および放射線影響研究所のHP をもとに作成。 放射線影響研究所の調査では、全白血病では原爆被爆後6-8年の間が発症率のピークとされる。 放射線影響研究所の詳細なデータは1950年の国勢調査から始まり、それ以前には推計もはいるが被爆2年後から白血病は増え始めていると考えられている。 当然、被曝線量が多いほど白血病での死亡率は高く、1Gy以上の被曝者では約2700人中56人が放射線が原因の白血病で亡くなったと考えられ、0. 005-0. 1Gyの被曝者約3万人では白血病での死亡は69人、その中で放射線被曝していなくても発症・死亡したであろう自然発生率を勘案して除去した過剰発生は4人とされている。 被曝者の白血病は AML, ALL, CML で顕著であり、CLL は目立たない (放射線被曝量の単位については脚注 を参照のこと)。 原爆による放射線被曝による白血病とがんの発生の違い [ ] 広島・長崎の被爆者の白血病と白血病以外の癌・悪性腫瘍では過剰発生の傾向は異なる。 前述のように放射線影響研究所の調査では慢性白血病と急性白血病の合計である全白血病では被爆から6-8年後がピークでその後は緩やかに発症率は下がっているが 、白血病以外のがんの過剰発生は被爆後10年を経て目立つようになりその後も年々過剰発生は増え2010年現在でも過剰発生の状況は続いている。 一つの理由として白血病では染色体の転座や逆位などでキメラ遺伝子が形成されて発生するものが多い。 癌でも白血病でも一つの遺伝子異常だけではがん化はせず何段階かの遺伝子異常が重なってがん化するが(CML は例外である )白血病に多いキメラ遺伝子のような大きな遺伝子異常ではがん化に必要なステップは少なく、放射線被曝によって最初の大きな遺伝子異常(キメラ遺伝子)がおきると白血病発生に必要な残りの遺伝子異常は少なく、遺伝子異常が積み重なるために必要な時間は少ない。 しかし、白血病以外のがんでは小さな遺伝子変異が数多く積み重なって発生するものが多いので放射線被曝によって遺伝子異常の First hit が生じてもそれに多くの遺伝子異常が積み重なる時間が必要なため、放射線被曝からがん発生まで長い時間が必要になると考えられる。 チェルノブイリ原発事故と白血病 [ ] 国連によって設置された( United Nations Scientific Committee on the Effects of Atomic Radiation:略称 UNSCEAR)の2008年の報告では、チェルノブイリ原発事故において放射線汚染除去作業者(数十万人)のなかでの高線量被曝者では白血病発生が見られるとされている。 また、チェルノブイリ汚染地域の一般住民では1986年の事故発生日から数週間以内に生産された牛乳を飲んだ子供たちに甲状腺がんが高率に発生していることは判明しているが 、白血病に関してはチェルノブイリ汚染地域の一般住民に明らかな白血病発症率の増加の証拠は無いとしている。 また、同じ報告書で原子放射線の影響に関する国連科学委員会は(高レベル被曝した作業員と1986年にチェルノブイリ地域の牛乳を飲んだ小児・青少年を除く)地域一般住民は放射線被曝による健康被害を心配する必要はないと結論付けている。 マヤーク核兵器生産炉周辺での白血病増加 [ ] チェルノブイリ原発事故では作業員を除く地域住民には明らかな白血病の増加の証拠は見つかっていないが、1956年に停止されたでは作業員だけでなく周辺住民にも白血病の増加が観測されている。 ロシアのマヤーク核兵器生産炉では核兵器用のプルトニウムを生産していたが、プルトニウム生産過程で生じたが周辺環境に放出されている。 チェルノブイリで主に問題になった放射性ヨウ素は甲状腺に溜まるために甲状腺がんが増加したが、マヤーク核兵器生産炉で放出されたストロンチウム90はカルシウムと化学的性質が類似するため骨に集まる性質があるので白血病の増加は予想されていた。 マヤーク核兵器生産炉の作業員および周辺住民では1953-2005年の間に93人が白血病になり、明らかに放射線被曝量が多いほど白血病リスクは高くなる。 ストロンチウム90による過剰相対リスクERRは4. 9倍になっている。 (マヤーク核兵器生産炉事故についてはを参照のこと) その他の放射線被曝と白血病 [ ] 医療行為でも患者で脊椎に放射線照射を受けた者、に対しての放射線治療で骨髄に放射線を浴びた者では数年後に慢性骨髄性白血病の発症率が高くなっていることが報告されている。 ただし、これらの放射線被曝量は日常生活ではありえない放射線量であり、これらの放射線が原因と思われる慢性骨髄性白血病は慢性骨髄性白血病患者全体の中では例外と言えるほど少なく、大半の慢性骨髄性白血病の発生原因は不明である。 航空会社国際線のパイロットや客室乗務員は地上に暮らす一般人よりも多くの自然放射線を浴びている。 地上の一般人に比べ特に中性子線の被曝量が多い。 その被曝量は年に3-6mSv程度と推定されている。 彼らの白血病リスクは増大しているとの報告もあるが、しかし症例が少なすぎて被曝線量と発症リスクの相関を示せるほどはっきりした事は判明していない(白血病は現役世代では10万人あたり年に数人程度の発症率である)。 またの発生例も報告されているが、やはり症例が少なすぎて被曝線量と発症リスクの相関は明らかではない。 アメリカ医学会での1944年と1950年の報告では放射線科医はそれ以外の診療科の医師に比べ白血病死亡率は10倍高く、イギリスでも放射線防御の意識が低かった1921年以前の放射線科医ではガンによる死亡率は明らかに高いことが報告されている。 ただし、放射線防護対策が確立した1950年以降では放射線科医の白血病発症が多いと言うデータは無くなっている。 白血病患者への支援 [ ] 医療制度は各国でさまざまであるが、移植医療を支える骨髄バンクや臍帯血バンクは先進国を中心に世界約50カ国にあり、2012年現在世界的な骨髄ドナー検索システム Bone Marrow Donors Worldwide :BMDW が構築され、骨髄に関しては48カ国66の骨髄バンクが参加し登録ドナーは1875万人、臍帯血でも29カ国から43の臍帯血バンクが BMDW に参加し、登録された臍帯血のストックは51万本になっている。 日本における白血病患者に対する支援 [ ] 白血病は厳しく難しい病気ではあるが、治療費助成のある(いわゆる難病)には指定されていない。 しかし18歳未満の小児白血病にはによって保健福祉事務所あるいはに必要書類を添えて申請すれば自治体による助成を受けられる ので小児白血病の治療費の患者負担は大きくはない。 さらに治療費の助成だけでなく小児白血病では所得制限などの条件があるが や財団法人 などの経済的支援を得られることもあり、あるいは企業による活動 などもある。 なので小児白血病では各種の制度を活用すれば保護者の経済的な負担は大きくはない。 成人の白血病の治療費は高額になるが日本の健康保険ではを利用できる。 移植が必要な患者にはや各地に設けられた臍帯血バンクなどの準公的な組織が患者の移植の支援のために活動している。 2011年末時点では骨髄バンクでは約40万人のドナー登録があり 、臍帯血バンクでは3万本のストックがある。 白血病患者が日本骨髄バンクを利用する際の患者負担金については前年度の所得税額が一定額以下の場合には一部もしくは全額が免除される仕組みもある。 日本人は民族的に遺伝学的な均一性が高く、そのために日本人同士でHLA型が一致する確率が高く、2004年の数字では世界で750万人の骨髄ドナーがいる中で日本人の骨髄ドナーは18万6千人と少数であったにもかかわらず、2004年時点で移植の総件数でも、人口当たりの移植数でも日本は世界第2位であった(1位はアメリカである)。 しかし、登録ドナーが40万人を超えた2012年現在でもすべての患者にドナーが見つかるわけではない。 動物の白血病 [ ] 詳細は「」および「」を参照 白血病は人間ばかりでなく多くの・が罹る。 やペットでは牛、馬、羊、山羊、豚、猫、犬、鶏などで見られる。 家畜・ペットではリンパ性白血病が多くウイルス(レトロウイルス)感染によるものが多い。 犬では人間と同じく AML, ALL, まれに CML, CLL が見られ、その多くでは原因は不明である。 犬でも猫でも人間と同様に化学療法(抗がん剤)治療が行われるが、ほとんどは4-6ヶ月以内に死亡する。 牛にも白血病はあり成牛型と散発型があり、成牛型はウイルスによるものであり、散発型は原因不明である。 成牛型は牛白血病ウイルス BLV によるもので潜伏期間が長く成牛になってから発症する。 牛ではウイルス蔓延を防ぐために病牛は治療はせず数週で死亡する。 馬ではリンパ腫は散発的に見られるものの白血病は少ない。 犬・猫では白血病やリンパ腫の治療に骨髄移植も試みられている。 犬の骨髄移植ではが重く死亡例が多い。 猫ではなどの免疫抑制を行うと成功率は高く GVHD も軽めである。 脚注 [ ] 註釈 [ ]• 慢性骨髄性白血病では一見正常な白血球や血小板が増加し、慢性リンパ性白血病でも一見正常なリンパ球が増加するが、それらはあくまで正常な血球ではない• 19閲覧、 2012. 19閲覧• ただし、白血病細胞は固まりは作らないが、白血病細胞がリンパ節や歯肉、など各種臓器に浸潤してそこで腫瘤を作ることはある、この腫瘤は白血病の本体ではないので外科的に取り除いても根本治療にはならない• FAB分類AML-M6では白血病細胞の半数は赤血球の幼若球である赤芽球に似ていて赤白血病とも呼ばれ、AML-M7では白血病細胞は骨髄系細胞の証であるMPOは発現せず、巨核球系の抗原が発現していて急性巨核芽球性白血病と呼ばれる。 - 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、pp. 180-181• 骨髄系細胞は血液細胞でリンパ球以外の細胞である。 顆粒球(好中球、好酸球、好塩基球)、単球、赤血球、血小板やその母細胞などである。 造血幹細胞が分化・増殖を始めると最初にリンパ系と骨髄系に分化の方向が分かれる。 -出典 大西 俊造、梶原 博毅、神山 隆一 監修『スタンダード病理学』第3版、文光堂、2009年、pp. 400-402• -直江 知樹、他 編『WHO血液腫瘍分類』医薬ジャーナル社、2010年、p. 108• 2006年現在でも AML-M3 以外の急性骨髄性白血病では 7日間とダウノルビシンなど系抗がん剤3日間の寛解導入療法は標準である。 -浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1414• ラテン語のleucaemia(白血病)は合成語 ae とされ、ラテン語の語頭の leuc はギリシャ語の「白い」から、ラテン語で血液の状態を表す aemia はギリシャ語の「血」からの由来である。 15及びp. 305• AML-M3急性前骨髄性白血病 APL では、生命に関わる大規模な出血が多いが、それは単に骨髄で白血病細胞が増えることで血小板数が減るからだけではなく、APL細胞の持つ組織因子によって高度な線溶活性化を伴う播種性血管内凝固症候群 disseminated intravascular coagulation:DIC を起こすからである。 白血病細胞が脳や脊髄などの中枢神経に浸潤すると頭痛・嘔吐・視力障害・・眼球運動麻痺などの症状が現れる。 -出典 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1431• 正常な(やの)では、造血細胞と脂肪がそれぞれある程度存在する。 骨髄内を造血細胞と脂肪がそれぞれ数割ずつ占めるのを正形成という。 骨髄内に造血細胞がほとんどなく脂肪ばかりなのを低形成。 脂肪がなくて造血細胞がぎっしり詰まっているのを過形成という。 低形成骨髄の典型が、過形成骨髄の典型が白血病である。 小児白血病では急性リンパ性白血病 ALL が多く、小児のALLでは2-3歳が発症率のピークとされ、特に男児に多い。 2-3歳男児のALLが小児白血病の発症率を引き上げているので、他の年齢・性別の小児では白血病はそれほど多い疾患ではない-浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1449-1450• 急性リンパ性白血病バーキット型でも欧米や日本で多い散発型や免疫不全型ではウイルスとの関連は指摘されていない• ただし、白血病は乳児・小児や若い人にもおき、一段階の遺伝子異常でおこる白血病(慢性骨髄性白血病)もあるのですべてではない。 白血病は融合遺伝子などの大きな遺伝子変異を持っているものが多いが、そのかわり細胞ががん化するまでに必要な遺伝子変異の数は「がん」に比べると少ないことが示唆されている。 -稲葉 俊哉「放射線がんにおけるエピゲノム制御異常の役割」『広島医学』Vol. 63 No. 4、広島医学会、2010年、pp. 236-240• 急性白血病で白血病細胞が MPO 陰性でリンパ系マーカーが陽性ならば ALL である。 ALL の細胞起源は未熟なリンパ系細胞である。 急性白血病で細胞が MPO陽性または顆粒系マーカーもしくは巨核球マーカーもしくは非特異的エステラーゼ NSE が陽性等の骨髄系細胞の特徴を示すならば AML、CML では顆粒系細胞(好中球、好塩基球)の増殖を主とし、CLL では細胞はリンパ球の性質を持つ-出典 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1377,1430および日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、pp. 2,3,36,41,48 ごく稀に細胞系列のはっきりしない物がある。 それについては 系統不明な白血病で説明する。 この転座は t 9;22 q34;q11 と略して表記する。 -薄井 紀子「白血病幹細胞を標的とする薬剤開発」『最新医学』Vol. 66 No. 3、最新医学社、2011年、pp. 409-415• これらの白血病も「慢性」で「骨髄性」であるが、慢性骨髄性白血病がフィラデルフィア染色体 Ph染色体)陽性と定義されてしまったために、骨髄性でPh染色体陰性の慢性白血病は4つの大分類から外れる• 急性白血病では寛解に入っていない非寛解期に移植をしても失敗する可能性は高いためにまずは寛解にもっていく必要がある。 一旦寛解したのち運悪く再発してしまった後に再度の抗がん剤治療で寛解導入した第2寛解期での移植での5年生存率は58. なので最初から再発する可能性が高いと予想される高リスク(予後不良)群ではなるべく早い寛解期、状況によっては第一寛解期(最初の寛解で再発はまだしていない)に移植を推奨されることがある。 予後が良いと予想される低リスク(予後良好)群では第一寛解期からの地固め療法でそのまま治癒になる可能性が高く、過酷でリスクの高い移植治療を無理に選択する必要はない。 なお、白血病細胞の治療抵抗性が高く寛解に至らない非寛解期での移植では5年生存率は22. 321 -なお最初から治療抵抗性で寛解に持って行けない難治性のAMLでは移植が唯一長期生存が期待できる方法である。 前述では22. 169。 慢性骨髄性白血病では治療抵抗性のある場合や急性転化した場合に移植を考慮する -直江 知樹 編『現場で役立つ血液腫瘍治療プロトコール集』医薬ジャーナル社、2011年、pp. 71-86。 慢性リンパ性白血病では緩やかな経過のものが多く、移植医療は試されているが標準治療にはなっていない -出典。 免疫不全マウスではリンパ球が存在しないか不活性なので異物の排除能力がなく、人の造血細胞を移植するとマウスの体内で人の造血細胞が定着し、マウスの体内で人の血液細胞が産出される。 もちろん、無菌状態で飼育しないと免疫不全マウスはすぐに感染症で死亡する。 60-63、放射線6Gyだけでも致死量と言われ-出典ブスルファン12. 放射線量や抗がん剤の量を増やすほど再発の可能性は低くなるが治療関連死は増える。 -出典、豊嶋 崇徳 編『造血幹細胞移植』医薬ジャーナル社、2009年、pp. 60-63• 造血幹細胞移植には同種(家族を含めた他人)からの移植と自家(自分の造血幹細胞)移植がある。 ソースの違いを含めて同種骨髄移植、同種末梢血幹細胞移植、同種臍帯血移植、自家骨髄移植、自家末梢血幹細胞移植の5つに細分される。 (自家臍帯血移植はほとんどない)-。 自家移植では移植片対宿主病 GVHD が無いメリットはあるが、移植片に白血病細胞が混じっている可能性が高く、移植片対白血病効果(GVL効果)も無い為に再発率が高く、白血病の治療としては自家移植は少ない。 AML-M3 以外の白血病の移植ではほとんどは同種移植である。 国立がん研究センターでもAML-M3以外の白血病では自家移植は推奨していない-ただし、AML-M3(急性前骨髄性白血病)では事前に白血病細胞の陰性を確認できるため AML-M3 では自家移植も行われる。 またAML-M3以外の白血病でもドナーが見つからないなどの場合に自家移植が行われることはある• 日本では基本は同じでも頻回の骨髄検査の結果で薬剤の加減をしながら様子を見る。 -出典 宮脇 修一「急性骨髄性白血病に対する化学療法の現在の到達点」『臨床血液』Vol,53 No. 1、日本血液学会、2012年、pp. 39-50および直江 知樹 編『現場で役立つ血液腫瘍治療プロトコール集』医薬ジャーナル社、2011年、pp. 9-19• 欧米ではシタラビンの大量療法が広く一般的行われている-出典 宮脇 修一「急性骨髄性白血病に対する化学療法の現在の到達点」『臨床血液』Vol,53 No. 1、日本血液学会、2012年、pp. 39-50および直江 知樹 編『現場で役立つ血液腫瘍治療プロトコール集』医薬ジャーナル社、2011年、pp. 9-19• 急性前骨髄球性白血病 AML-M3 のオールトランスレチノイン酸治療中にはレチノイン酸症候群と呼ばれる急激な白血球増加との呼吸不全が生じることがあり、また ATRA単剤では耐性を持ちやすい。 それらの予防としてアントラサイクリン系抗がん剤を併用する。 不幸にもが発症してしまった場合はを投与する。 -阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、p. 465- なお、ATRA治療中は、絶対にを投与してはいけない。 また、ATRA単剤では白血病細胞数が多い症例では寛解を得にくいが、抗がん剤を併用して細胞数を減らしながら ATRA を使用すると高い完全寛解率を得ることができる。 -大野竜三「急性前骨髄性白血病」『血液フロンティア』Vol. 13 No. 10、医薬ジャーナル社、2003年• G-CSF の投与は ALL では推奨されるが、AML ではケースバイケースであり、寛解状態での感染症のときに使われることがある。 -出典、日本血液学会 編集『血液専門医テキスト』南江堂、2011年、p. 248,439• CDとは細胞の表面に発現している抗原で多数の種類があり、細胞の種類によって発現している抗原は様々であり、抗原にはCD番号を振られている。 -阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、p. 2-1. -松村 到、金倉 譲「急性骨髄性白血病 AML における白血病幹細胞」『癌幹細胞-癌研究のパラダイムシフト』医歯薬出版、2009年、p. 5-11• -阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、pp. 17-42• マウスの造血幹細胞に BCR-ABL融合遺伝子のみ導入するとマウスは CML を発症するが、分化がある程度進んだマウスの造血前駆細胞に BCR-ABL融合遺伝子のみを導入してもマウスは CML は発症しない。 しかしマウスの造血前駆細胞に BCR-ABL融合遺伝子に加えて Hes1遺伝子を同時に導入すると CML の急性期と同じ状態になる。 つまりCMLの特徴を残しながら急性白血病の状態になる。 この場合、BCR-ABL融合遺伝子がクラスI変異、Hes1遺伝子がクラスII変異に相当し、さらにHes1遺伝子が細胞の未分化性を付与するものと考えられる。 -中原 史雄「慢性骨髄性白血病の急性転化におけるHes1の関与」『臨床血液』Vol. 52 No. 6、日本血液学会、2011年、pp. 329-336• ただし、白球病細胞を生み出す大元である白血病幹細胞はゆっくりではあるが自律的に細胞分裂を起こすので、コントロール下にあり大半が細胞の休眠期(G0期)にある正常な造血幹細胞に比べると細胞周期に入っている細胞は多いと考えられている。 ただし、白血病幹細胞にも休眠期 G0期)に入っているものは多い。 -浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1374• 15-19歳は小児科ではなく内科に掛かることもある。 -直江 知樹、他 編『血液疾患最新の治療. 2011-2013』南江堂、2010年、p. 149• 胸部レントゲン撮影で被曝量は0. 3mGy、胸部CT検査の被曝量は10mGyなので-出典、 0. 5Gyという被曝量は胸部レントゲン撮影の千倍以上、胸部CT検査の50回分を一度に受けたのと同等程度になる。 慢性骨髄性白血病の通常の発症率は年間10万人あたり1-1. 5人程度である。 この白血病の過剰発生数は1950年以前の数字は入っていないが、広島の臨床医らによって被爆約2年後から白血病は増え始めていたと報告されている。 2011. 9閲覧• 被曝量を表す単位はGy(グレイ)のほかSv(シーベルト)が用いられる。 補正係数はX線、ガンマ線、ベータ線は 1、陽子線は 5、アルファ線は 20、中性子線はエネルギーにより 5 から 20 までの値をとる。 原爆の直接被爆では中性子線も浴びるので0. 1Gyの被曝の影響は0. 1Sv=100mSv(ミリシーベルト)よりは大きくなる。 胸部CT検査はX線の検査なので胸部CT検査1回での放射線被曝量は10mGy=10mSvになる。 -浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1869• 被爆者の白血病の各病型では CML と ALL が最初に過剰発生のリスクが上昇したが終焉も早く10年程度、AML では過剰発生リスクは徐々に増加し CML, ALL に比べると終息も遅い。 また、白血病の類縁疾患である骨髄異形成症候群(MDS では過剰発生の傾向は白血病とは異なり1980年以降に増加が目立ち、その増加傾向は固形癌と同じである。 つまり原爆被爆によるがんでは慢性骨髄性白血病は潜伏期間が短く、急性骨髄性白血病がそれに続き、MDS や固形癌では長い。 -出典、朝長 万左男「被爆者白血病 造血器腫瘍 研究の新展開」『広島医学』Vol. 63 No. 4、広島医学会、2010年、pp. 227-235• CMLは一つの大きな遺伝子変異(BCR-ABL融合遺伝子)だけで発症するが-出典、CMLは被爆者のがん・白血病でも最初に増加傾向を示す-朝長 万左男「被爆者白血病 造血器腫瘍 研究の新展開」『広島医学』Vol. 63 No. 4、広島医学会、2010年、pp. 227-235• チェルノブイリ地域で子供に甲状腺がんが増加したのは放射性ヨウ素が付着した牧草を食べた牛が出した牛乳を飲み、放射性ヨウ素が甲状腺に蓄積したためである。 放射性ヨウ素の半減期は8日なので1987年以降の牛乳には放射性ヨウ素は含まれていない。 出典 [ ]• 2019年8月29日閲覧。 国立研究開発法人 東病院. 2019年8月29日閲覧。 2011. 17閲覧• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、p. 2012. 18閲覧• 大野 竜三 編集『よくわかる白血病のすべて』永井書店、2005年、pp. 301-309• 5』リブロ・サイエンス、2010年、p. 152• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、p. 162• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1395-1397• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1397-1398• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1376-1378• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、p. 117• 大西 俊造、梶原 博毅、神山 隆一 監修『スタンダード病理学』第3版、文光堂、2009年、pp. 400-402• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、pp. 107,131• 2015. 17閲覧• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1411• 301-309• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1434• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、p. 120• 2011. 04閲覧• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1425-1426,1436-1437• 松下 正幸 著『医学用語の成り立ち』榮光堂、1997年、前書きpp. 15及びp. 305• 寺野 彰 総編集『シンプル内科学』南江堂、2008年、p. 433• 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、p. 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、p. 152• 17閲覧• 6 改訂第7版、中山書店、2009年、pp. 112,113,115,119• 1431• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、p. 119• 大西 俊造、梶原 博毅、神山 隆一 監修『スタンダード病理学』第3版、文光堂、2009年、p. 416• 6 改訂第7版、中山書店、2009年、p. 122-123• 2012. 18閲覧• 244-246• 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、p. 188• 6 改訂第7版、中山書店、2009年、pp. 126-127• 2011. 24閲覧• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 543-548,553-555• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、pp. 3-4• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、pp. 98-99• 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、pp. 152-156• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 124-127• 永井 正 著『図解白血病・悪性リンパ腫がわかる本』法研、2008年、p. 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 536-542,1945-1954• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 113-115• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 116-120• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 124,127• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1374-1377• World Health Organization 2009年. 2009年11月11日閲覧。 宮内 潤、泉二 登志子 編『骨髄疾患診断アトラス : 血球形態と骨髄病理』中外医学社、2010年、p. 134• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、pp. 302-303• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、p. 126• 1489-1497• 22閲覧• 1430• 1375• 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、p. 22,188• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1476• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1449-50• 2012. 5閲覧• 2012. 5閲覧• 全がん患者数は全部位(pp. 74-75最上段)、白血病患者数はC91-C95白血病(pp. 76-77)参照• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 300• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 112-113• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1375• 2012. 12閲覧• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1489• 2012. 18閲覧• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、pp. 145-410• Cooper,Robert E. Hausman著『クーパー細胞生物学』須藤和夫,他,訳、東京化学同人、2008年、pp. 593-623• 浅島 誠、駒崎 伸二 共著『図解分子細胞生物学』裳華房、2010年、pp. 293-305• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 359• 折田 薫三 著『腫瘍免疫学』癌と化学療法社、2010年、pp. 1-15• 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、p. 152• 5』リブロ・サイエンス、2010年、pp. 149-151• 日本臨床腫瘍学会 編『新臨床腫瘍学』改訂第2版、南江堂、2009年、pp. 2-6• 日本臨床腫瘍学会 編『新臨床腫瘍学』改訂第2版、南江堂、2009年、pp. 28-30• 日本臨床腫瘍学会 編『新臨床腫瘍学』改訂第2版、南江堂、2009年、pp. 36-37• 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、pp. 152-155• 18閲覧• 112• 1475• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、p. 445• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、p. 112• 2012. 18閲覧• 1411• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、p. 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 58-60• 37-43• 82-89• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、pp. 107-109• 杉本恒明、矢崎義雄 総編集 『内科学』第9版、朝倉書店、2007年、pp. 1592-1599• 2011. 09閲覧• 2011. 09閲覧• 153• 806• 矢﨑義雄 総編集『内科学』第10版第4分冊、朝倉書店、2013年、pp. 1928-1929• 2011. 09閲覧• 杉本恒明、矢崎義雄 総編集 『内科学』第9版、朝倉書店、2007年、p. 1599• 矢﨑義雄 総編集『内科学』第10版第4分冊、朝倉書店、2013年、p. 1937• 宮脇 修一「急性骨髄性白血病に対する化学療法の現在の到達点」『臨床血液』Vol,53 No. 1、日本血液学会、2012年、pp. 39-50• 直江 知樹 編『現場で役立つ血液腫瘍治療プロトコール集』医薬ジャーナル社、2011年、pp. 9-19• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1386• 40-50• 日本血液学会 編集『血液専門医テキスト』南江堂、2011年、pp. 270-272• 木崎『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』第4版、2011年、pp. 162-163• 日本血液学会 編集『血液専門医テキスト』南江堂、2011年、pp. 274-275• 黒田 純也、山本 未央、谷脇 雅史「慢性骨髄性白血病の細胞死の抑制」『血液内科』Vol. 62 No. 2、科学評論社、2011年、pp. 159-165• 37-43• 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、pp. 24-27• 薄井 紀子「白血病幹細胞を標的とする薬剤開発」『最新医学』Vol. 66 No. 3、最新医学社、2011年、pp. 409-415• 直江 知樹 編『現場で役立つ血液腫瘍治療プロトコール集』医薬ジャーナル社、2011年、pp. 71-86• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、pp. 445-448• 6 改訂第7版、中山書店、2009年、pp. 127-128• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、pp. 445-446• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、p. 447• 448-449• 606-633• Skeel, Roland T 編集『癌化学療法ハンドブック』第6版、古江 尚、他 訳、メディカル・サイエンス・インターナショナル、2009年、pp. 487-488• 2012,02,02閲覧• 2012. 02閲覧• 5-11• 37-43• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1374• 平尾 敦「白血病幹細胞を標的にした新たな治療法の開発」『臨床血液』Vol. 52 No. 7、日本血液学会、2011年、pp. 484-489• 宮崎 泰司「急性骨髄性白血病の分子病態と診断」『血液内科』Vol. 62 No. 5、科学評論社、2011年、pp. 643-648• 金倉 譲 監修『血液診療エキスパート 白血病』中外医学社、2009年、pp. 2-13• 直江 知樹、他 編『WHO血液腫瘍分類』医薬ジャーナル社、2010年、p. 仲 一仁、平尾 敦「CML幹細胞の制御メカニズム」『Annual Review 血液 2011』、中外医学社、2011年、pp. 8-14• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 123-124• 鶴尾 隆 編『がんの分子標的治療』南山堂、2008年、pp. 262-267• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 298-300• 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、p. 149• 黒川 清 松澤 佑次 編集主幹『内科学』第二版、2分冊の2、文光堂、2003年、p. 1365• 杉本恒明、矢崎義雄 総編集 『内科学』第9版、朝倉書店、2007年、p. 1655• 2011-2013』南江堂、2010年、p. 149• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1449-1450• 1449-1456• 直江 知樹、他 編『血液疾患最新の治療. 2011-2013』南江堂、2010年、pp. 149-150• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1450,1457• 1418• 直江 知樹、他 編『血液疾患最新の治療. 2011-2013』南江堂、2010年、p. 145• 宮腰 重三郎「高齢者造血器腫瘍の病態と治療」『血液内科』Vol. 62 No. 6、科学評論社、2011年、pp. 169-175• 直江 知樹、他 編『血液疾患最新の治療. 2011-2013』南江堂、2010年、p. 147• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1408-1409,1457• 松尾 恵太郎 伊藤 秀美「骨髄性白血病の疫学」『日本臨床』Vol. 67 No. 10、日本臨床社、2009年、pp. 1847-1851• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、pp. 309-313• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1480-1483• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 1400-1401• 153-159• 宮内 潤、泉二 登志子 編『骨髄疾患診断アトラス : 血球形態と骨髄病理』中外医学社、2010年、p. 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、p. 1401• 押味和夫 監修 木崎 昌弘 松村 到 編 『造血器腫瘍治療』第2版、中外医学社、2010年、pp. 47-50• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、pp. 925-928• 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、p. 181• 井上 大地、北村 俊雄「骨髄異形成症候群の病態・進展とアポトーシス」『血液内科』Vol. 62 No. 2、科学評論社、2011年、pp. 142-148• 12,48,98• 108-109• 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、pp. 105-109• 161-195• 直江 知樹、他 編『WHO血液腫瘍分類』医薬ジャーナル社、2010年、pp. 232-263• 日本血液学会、日本リンパ網内系学会 編集『造血器腫瘍取扱い規約』金原出版、2010年、p. 東田 俊彦著 『iMedicine. 5』リブロ・サイエンス、2010年、pp. 172,203• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、pp. 115-116• 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、pp. 155-159• 2011. 29閲覧• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、p. 225• 村川 裕二 総監修『新・病態生理できった内科学 5 血液疾患』第2版、医学教育出版社、2009年、p. 130• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、p. 123• 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、p. 26閲覧• 63 No. 4、広島医学会、2010年、pp. 236-240• 第1巻 線源 』 放射線医学総合研究所発行、2011年、pp. 16-17• 196• 1460• 佐渡敏彦 著『放射線は本当に微量でも危険なのか? : 直線しきい値なし〈LNT〉仮説について考える』医療科学社、2012年、p. 2012. 21閲覧• 2012. 21閲覧• 14 No. 8、医薬ジャーナル社、2004年• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 12閲覧• 2012. 21閲覧• 新獣医学辞典編集委員会 編集『新獣医学辞典』チクサン出版社、2008年、p. 1062• 日本獣医内科学アカデミー 編集『獣医内科学』改訂版 小動物編、文永堂出版、2011年、pp. 456-460• 日本獣医内科学アカデミー 編集『獣医内科学』改訂版 大動物編、文永堂出版、2011年、pp. 221-213• Ian R. Tizard 原著『イラストでみる獣医免疫学』古澤修一、保田昌宏、多田富雄 監訳、インターズー、2011年、p. 340 参考文献 [ ] 書籍• 浅島 誠、駒崎 伸二 共著『図解分子細胞生物学』裳華房、2010年、• 浅野茂隆、池田康夫、内山卓 監修 『三輪血液病学』文光堂、2006年、• 阿部 達生 編集『造血器腫瘍アトラス』改訂第4版、日本医事新報社、2009年、• 大西 俊造、梶原 博毅、神山 隆一 監修『スタンダード病理学』第3版、文光堂、2009年、• 大野 竜三 編集『よくわかる白血病のすべて』永井書店、2005年、• 大野 竜三、小寺 良尚 監修『白血病治療マニュアル』改訂第三版、南江堂、2009年、• 小川聡 総編集 『内科学書』Vol. 6 改訂第7版、中山書店、2009年、• 押味和夫 監修『WHO分類第4版による白血病・リンパ系腫瘍の病態学』中外医学社、2009年、• 押味 和夫 編著『カラーテキスト血液病学』中外医学社、2007年、• 押味和夫 監修 木崎 昌弘 松村 到 編 『造血器腫瘍治療』第2版、中外医学社、2010年、• 折田 薫三 著『腫瘍免疫学』癌と化学療法社、2010年、• 金倉 譲 監修『血液診療エキスパート 白血病』中外医学社、2009年、• 木崎 昌弘 編著『白血病・リンパ腫・骨髄腫 : 今日の診断と治療』 第4版、中外医学社、2011年、• 黒川 清 松澤 佑次 編集主幹『内科学』第二版、2分冊の2、文光堂、2003年、• 原子放射線の影響に関する国連科学委員会 編集、放射線医学総合研究所 監訳『 放射線の線源と影響 : 原子放射線の影響に関する国連科学委員会UNSCEAR 2008年報告書. 第1巻 線源 』 放射線医学総合研究所発行、2011年、• 佐渡敏彦 著『放射線は本当に微量でも危険なのか? : 直線しきい値なし〈LNT〉仮説について考える』医療科学社、2012年、• 新獣医学辞典編集委員会 編集『新獣医学辞典』チクサン出版社、2008年、• 杉本恒明、矢崎義雄 総編集 『内科学』第9版、朝倉書店、2007年、• 矢﨑義雄 総編集『内科学』第10版第4分冊、朝倉書店、2013年、•
次の